题目内容
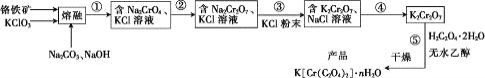
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:
回答下列问题:
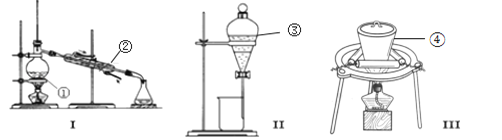
(1)“熔融”的装置如图,坩埚W的材质可以是________(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为_______________。
(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为________,“调pH为7~8,加热煮沸半小时”的目的是__________。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为________。
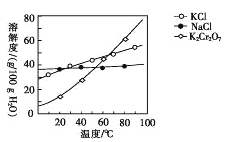
(4)步骤④包含的具体操作有____,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)
(5)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是________。
(6)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
【答案】铁 ![]() Fe2O3、Fe(OH)3 使AlO2-、SiO32-水解为Al(OH)3和H2SiO3,过滤除去 2CrO42-+2H+
Fe2O3、Fe(OH)3 使AlO2-、SiO32-水解为Al(OH)3和H2SiO3,过滤除去 2CrO42-+2H+![]() Cr2O72-+H2O 加热浓缩、冷却结晶、过滤并洗涤 研钵 3
Cr2O72-+H2O 加热浓缩、冷却结晶、过滤并洗涤 研钵 3
【解析】
铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等),与KClO3 及NaOH、Na2CO3发生反应,熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl及NaFeO2 等,主要的反应为:![]() ,水浸,过滤,调pH为7-8,加热煮沸半小时,趁热过滤,除去不溶的Fe2O3以及反应NaFeO2+2H2O═Fe(OH)3↓+NaOH生成的Fe(OH)3沉淀,滤液含有Na2CrO4、Na2SiO3、NaAlO2、KCl及等,再调节pH除去Na2SiO3、NaAlO2,得到含有Na2CrO4、KCl的溶液,加入稀硫酸发生反应:2CrO42-+2H+
,水浸,过滤,调pH为7-8,加热煮沸半小时,趁热过滤,除去不溶的Fe2O3以及反应NaFeO2+2H2O═Fe(OH)3↓+NaOH生成的Fe(OH)3沉淀,滤液含有Na2CrO4、Na2SiO3、NaAlO2、KCl及等,再调节pH除去Na2SiO3、NaAlO2,得到含有Na2CrO4、KCl的溶液,加入稀硫酸发生反应:2CrO42-+2H+![]() Cr2O72-+H2O,加入KCl,Na2Cr2O7转化为K2Cr2O7,将溶液蒸发浓缩、冷却结晶,过滤并洗涤沉淀得到K2Cr2O7,加入草酸晶体和无水乙醇得到产品K[Cr(C2O4)2]·nH2O。
Cr2O72-+H2O,加入KCl,Na2Cr2O7转化为K2Cr2O7,将溶液蒸发浓缩、冷却结晶,过滤并洗涤沉淀得到K2Cr2O7,加入草酸晶体和无水乙醇得到产品K[Cr(C2O4)2]·nH2O。
(1)高温下陶瓷或玻璃中的SiO2会与NaOH及Na2CO3发生反应;由流程分析可知6FeOCr2O3、Na2CO3和KClO3在加热条件下生成Na2CrO4、Fe2O3、KCl和CO2,结合质量守恒写出发生反应的化学方程式;
(2)熔渣中的Fe2O3和生成的Fe(OH)3均不溶于水;根据盐的水解反应是吸热反应,从平衡移动角度分析;
(3)根据流程,酸化时,CrO42-→Cr2O72-,结合电荷守恒和原子守恒写出发生反应的离子方程式;
(4)根据溶解度随温度变化情况,选择结晶方法;
(5)结合常用仪器的性能判断;
(6)根据K[Cr(C2O4)2]·nH2O中水的质量分析为16.8%,即![]() =0.168计算。
=0.168计算。
(1)高温下陶瓷或玻璃仪器中的SiO2会与NaOH及Na2CO3发生反应,因此应选用铁坩埚;
由流程中的产物及已知条件可知反应方程式为![]() ;
;
(2)根据分析第一次过滤的滤渣为熔渣中的Fe2O3以及反应NaFeO2+2H2O=Fe(OH)3↓+NaOH生成的Fe(OH)3;由于NaAlO2、Na2SiO3是强碱弱酸盐,在溶液中存在水解平衡,水解产生Al(OH)3、H2SiO3,由于盐的水解反应是吸热反应,根据温度对盐的水解的影响,“调pH为7-8,加热煮沸半小时”的目的是使AlO2-、SiO32-水解为Al(OH)3和H2SiO3,过滤除去;
(3)根据流程,酸化时,CrO42-→Cr2O72-,结合电荷守恒和原子守恒,可得发生反应的离子方程式2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(4)依据溶解度曲线,步骤④包含的操作有蒸发浓缩、冷却结晶,过滤并洗涤,经干燥得到K2Cr2O7晶体;
(5)实验室研磨固体时,所用硅酸盐质仪器为研钵;
(6) K[Cr(C2O4)2]·nH2O的相对分子质量为267+18n,由题意知![]() =0.168,解得n=3。
=0.168,解得n=3。