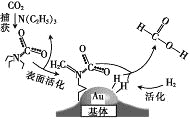
题目内容
【题目】按要求填空:
(1) 除去KNO3中混有的SO42-应选择的除杂试剂为__________;
(2) 向沸腾的蒸馏水中滴加饱和FeCl3溶液可制取Fe(OH)3胶体,用化学方程式表示该方法的原理:_______;
(3) 在水溶液中,KHSO4的电离方程式为:______________________________;
(4) 盐酸与氢氧化钠溶液反应的离子方程式为:__________________________;
(5) CO2与足量澄清石灰水反应的离子方程式:__________________________;
(6) 硫酸铜溶液与氢氧化钡溶液反应的离子方程式为:____________________ ;
(7)小苏打常作为食品制作过程中的膨松剂,其溶液与稀HNO3反应的离子方程式为:___;
【答案】Ba(NO3)2 FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl KHSO4=K++H++SO42- OH-+H+=H2O CO2+Ca2++2OH-=CaCO3↓+H2O Cu2++2OH-+SO42-+Ba2+=Cu(OH)2↓+BaSO4↓ HCO3-+H+=CO2
Fe(OH)3(胶体)+3HCl KHSO4=K++H++SO42- OH-+H+=H2O CO2+Ca2++2OH-=CaCO3↓+H2O Cu2++2OH-+SO42-+Ba2+=Cu(OH)2↓+BaSO4↓ HCO3-+H+=CO2![]() +H2O
+H2O
【解析】
(1)欲除去KNO3溶液中的SO42-,先加过量Ba(NO3)2,除去SO42-,除杂试剂为Ba(NO3)2;
(2)Fe(OH)3胶体制备,是向沸腾的蒸馏水中加入几滴饱和FeCl3溶液并继续加热至液体变成红褐色,制备Fe(OH)3胶体的化学方程式为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(3)硫酸氢钾在水中完全电离出钾离子、氢离子、硫酸根离子,电离方程式为:KHSO4=K++H++SO42-;
(4)稀盐酸与氢氧化钠溶液反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O,氯化氢、氢氧化钠、氯化钠都是易溶物、强电解质,离子方程式中需要拆开,该反应的离子方程式为:OH-+H+=H2O;
(5)CO2与足量澄清石灰水反应,产生了CaCO3,离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O;
(6)硫酸铜溶液与氢氧化钡溶液反应生成硫酸钡和氢氧化铜沉淀正确的离子方程式为:Cu2++2OH-+SO42-+Ba2+=Cu(OH)2↓+BaSO4↓;
(7)小苏打(NaHCO3)与稀HNO3反应生成二氧化碳和水,离子方程式为:HCO3-+H+=CO2![]() +H2O。
+H2O。

【题目】在20 L的密闭容器中按物质的量之比为1∶2充入CO和H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH。测得CO的转化率随温度及不同压强下的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如表所示。下列说法正确的是( )
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强下的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如表所示。下列说法正确的是( )
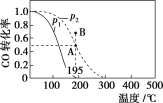
p2及195 ℃ 时n(H2)随时间变化
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A. p1>p2,ΔH<0
B. 在p2及195 ℃ 时,反应前3 min的平均速率v(CH3OH)=0.8 mol·L-1·min-1
C. 在p2及195 ℃ 时,该反应的平衡常数为25
D. 在B 点时,v正>v逆
【题目】实验室用63%的浓硝酸(其密度为1.4g/mL)配制240mL0.50mol/L稀硝酸,若实验仪器有:A 10mL量筒 B 50mL量筒 C 托盘天平 D 玻璃棒 E 100mL容量瓶 F 250mL容量瓶 G 500mL容量瓶 H 胶头滴管 I 200mL烧杯。
(1)此浓硝酸的物质的量浓度为____________mol/L
(2)应量取63%的浓硝酸_____________mL,应选用___________。(填仪器的字母编号)
(3)实验时还需选用的仪器有______________(填仪器的字母编号)
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是______(填序号)。 |
A.可以按此建议改进,便于使用容量瓶 |
B.不能按此建议改进,因为会降低容量瓶的精确度 |
C.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响 |