题目内容
【题目】合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)1 m3(标准状况)CH4按上式完全反应,产生H2_________mol。(精确到0.1)
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1 m3(标准状况)CH4按上述两式完全反应,产物气体的体积V m3(标准状况)的取值范围为________。
(3)CH4和H2O(g)及富氧空气(O2含量较高的空气)混合反应,产物气体组成如下表:
气体 | CO | H2 | N2 | O2 |
体积(L) | 25 | 60 | 15 | 2.5 |
计算该富氧空气中O2和N2的体积比,V(O2):V(N2)=________。
(4)若CH4和H2O(g)及(3)题中的富氧空气混合反应,产物气体中V(H2):V(N2)=3:1(合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为_______。
【答案】133.9 3 <V<4 ![]() 1:15
1:15
【解析】
⑴根据第1个方程式,先算出甲烷的物质的量,再计算氢气的物质的量。
⑵用极限思维,假设全部发生第1个反应,算出气体量,假设全部发生第2个反应,算出气体量,根据极限思维,只能是两者之内。
⑶用方程式建立关系,依据生成一氧化碳和氢气的量建立方程式进行计算,再计算氧气和氮气的量的关系。
⑷用方程式建立关系,利用已知氢气与氮气的量之比为3:1建立方程式,再用⑶中的关系结合一起得出答案。
⑴1 m3(标准状况)CH4体积为1000L,其物质的量![]() ,按上式完全反应,产生H2物质的量44.64 mol×3 = 133.9mol,故答案为133.9 mol。
,按上式完全反应,产生H2物质的量44.64 mol×3 = 133.9mol,故答案为133.9 mol。
⑵1 m3(标准状况)CH4按照第1个方程式得出生成的气体体积为4 m3,按照第2个方程式得出生成的体积为3 m3,因此1 m3(标准状况)CH4按上述两式完全反应,产物气体的体积V m3(标准状况)的取值范围为3 <V<4,故答案为:3 <V<4。
⑶
建立关系 x + y = 25 ,3x + 2y =60,解得x = 10,y = 15,因此该富氧空气中O2和N2的体积比,V(O2):V(N2)=(0.5×15 + 0.5):15 =2:3,故答案为2:3。
⑷![]()
根据信息得出V(H2):V(N2)=(3z + 4d):1.5d = 3:1,则z:d= 1:6,则H2O(g)和富氧空气的体积比为z:2.5d =1:2.5×6 =1:15,故答案为:1:15。

 新思维假期作业寒假吉林大学出版社系列答案
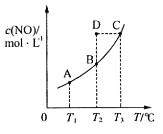
新思维假期作业寒假吉林大学出版社系列答案【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
容器(温度) | t(min) c(molL-1) | 0 | 40 | 80 | 120 | 160 |
甲(400℃) | c(NO) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(400℃) | c(NO) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙(T℃) | c(NO) | 2.00 | 1.40 | 1.10 | 1.10 | 1.10 |
A.达到平衡状态时,2v正c(NO)=v逆c(N2)
B.容器内压强不再改变说明反应已达平衡
C.丙容器中从反应开始到建立平衡的平均反应速率v c(NO)=0.01125 mol·L-1·min-1
D.由表格数据可知:T>400
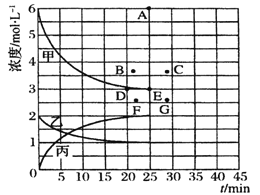
【题目】工业合成氨反应为Nz(g)+3H2(g) ![]() 2NH3(g),对其研究如下:在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1L 的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表;
2NH3(g),对其研究如下:在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1L 的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1) 前10min 中利用N2表示的反应速率为________
(2) 该温度下,此反应的平衡常数K=__________
(3) 该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正_______v逆(填“>”、“<”或“=”)。
(4) 该温度下,在上述平衡体系中再通入2molNH3,一段时间后,达到新的平衡。此时c(H2)____ 4.5mo1/L(填“>”、“<”或“=”)。
(5) 由上表中的实验数据计算得到“浓度-时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______。在此温度下,若起始充入4 mol Nz 和12 mol Hz,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_______。