题目内容
【题目】银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O==Zn(OH)2+2Ag,其工作示意图如图。下列说法不正确的是:

A. Ag2O电极是正极
B. 电子由Zn电极流出,经过KOH溶液流入Ag2O电极
C. Zn电极的电极反应式:Zn-2e-+2OH-==Zn(OH)2
D. 溶液中OH-向负极移动
【答案】B
【解析】
根据电池总反应,可知Zn为电池的负极,电极反应式为Zn-2e-+2OH-==Zn(OH)2,Ag2O为电池的正极。
A. Ag2O电极是正极,A正确;
B. 电子由电池负电极流出,经过导线流入电池正电极,B错误;
C. Zn电极的电极反应式:Zn-2e-+2OH-==Zn(OH)2,C正确;
D. 根据电池的负极方程式可知,溶液中OH-向负极移动,D正确;
故答案选B。

【题目】钛被誉为“21世纪的金属”,可呈现多种化合价。其中以+4价的Ti最为稳定。
(1)基态Ti原子的价电子轨道表示式为_______________。
(2)已知电离能:I2(Ti)=1310kJ/mol,I2(K)=3051kJ/mol。I2(Ti)<I2(K),其原因为________。
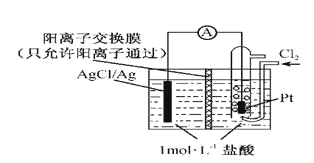
(3)钛某配合物可用于催化环烯烃聚合,其结如图所示:
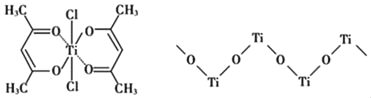
①钛的配位数为_____,碳原子的杂化类型_____。
②该配合物中存在的化学键有___________(填字母标号)。
a.离子健 b.配位键 c.金属健 d.共价键 e.氢键
(4)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如上图所示,该阳离子化学式为________,阴离子SO42—的空间构型为____。
(5)钛与卤素形成的化合物熔沸点如下表所示:
TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | ﹣24.1 | 38.3 | 155 |
沸点/℃ | 136.5 | 233.5 | 377 |
分析 TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是:_____。
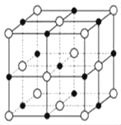
(6)已知TiN晶体的晶胞结构如下图所示,若该晶胞的密度ρg/cm3,阿伏加德罗常数值为NA,则晶胞中Ti原子与N原子的最近距离为________pm.(用含ρ、NA的代数式表示)
【题目】合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)1 m3(标准状况)CH4按上式完全反应,产生H2_________mol。(精确到0.1)
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1 m3(标准状况)CH4按上述两式完全反应,产物气体的体积V m3(标准状况)的取值范围为________。
(3)CH4和H2O(g)及富氧空气(O2含量较高的空气)混合反应,产物气体组成如下表:
气体 | CO | H2 | N2 | O2 |
体积(L) | 25 | 60 | 15 | 2.5 |
计算该富氧空气中O2和N2的体积比,V(O2):V(N2)=________。
(4)若CH4和H2O(g)及(3)题中的富氧空气混合反应,产物气体中V(H2):V(N2)=3:1(合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为_______。