题目内容
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是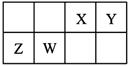
| A.Y元素最高价氧化物对应的水化物化学式为H2YO3 |
| B.原子半径由小到大的顺序为:Y<X<W<Z |
| C.室温下,Z和W的单质均能溶于浓硝酸 |
| D.X、Z两种元素的氧化物中所含化学键类型相同 |
B
解析试题分析:根据元素在周期表中的相对位置可知,Z位于第三周期。由于Z元素原子核外K层与M层电子数相等,所以Z是Mg元素,则W是Al,X是C,Y是N。A、氮元素的在最高价是+5加÷价,所以N元素最高价氧化物对应的水化物化学式为HNO3,A不正确;B、同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,因此四种元素的原子半径由小到大的顺序为:Y<X<W<Z,B周期;C、在常温下铝在浓硝酸中发生钝化,不能溶解在浓硝酸中,C不正确;D、氧化镁含有离子键,CO2中含有极性键,化学键类型不同,D不正确,答案选B。
考点:考查位置、结构和性质的有关判断

练习册系列答案
相关题目
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
B.D、E形成的简单离子的还原性E->D-
C.气态氢化物的稳定性HD<H2C
D.最高价氧化物对应的水化物的酸性 H2CO4>HEO4
短周期元素W、X、Y、Z的原子序数依次增大,下列相关比较错误的是
| A.稳定性:H2X H2Z | B.酸性:H2ZO3<H2ZO4 |
| C.还原性:W-<Z2- | D.半径:Y3+<Z2- |
短周期元素的四种离子aW3+、bX+、cY2-、dZ- 它们的电子层结构相同,下列关系正确的是
| A.质子数c>d | B.离子的还原性Y2->Z- |
| C.氢化物的稳定性H2Y>HZ | D.原子半径X<W |
若某原子的外围电子排布式为4d15s2,则下列说法正确的是
| A.该元素在元素周期表中的位置为第五周期IIIB |
| B.该元素位于s区 |
| C.该元素原子为非金属 |
| D.该元素原子N能层共有8个电子 |
依据元素周期表及元素周期律,下列推断正确的是
| A.H3BO3的酸性比H2CO3的强 |
| B.Mg(OH)2的碱性比Be(OH)2的强 |
| C.HCl、HBr、HI的热稳定性依次增强 |
| D.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是
| A.原子半径的大小顺序: r(Y)>r(Z)>r(W) |
| B.元素Z、W 的简单离子的电子层结构不同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
已知33As、35Br位于同一周期,下列关系正确的是
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |