题目内容
短周期元素W、X、Y、Z的原子序数依次增大,下列相关比较错误的是
| A.稳定性:H2X H2Z | B.酸性:H2ZO3<H2ZO4 |
| C.还原性:W-<Z2- | D.半径:Y3+<Z2- |
C
解析试题分析:短周期元素W、X、Y、Z的原子序数依次增大,X、Z的氢化物是H2X 、H2Z形式,Z在X的下一周期。同族元素从上到下,非金属性逐渐减弱,氢化物的稳定性逐渐减弱。A正确。B同种元素形成的不同价态的酸,价态越高酸性越强。正确。C非金属性X<Z,还原性:X-〉Z2-错误。D对于电子层数不同的离子,离子的电子层数越多,离子半径就越大。离子半径:Y3+<Z2-正确。
考点:考查元素周期律中关于物质的稳定性、还原性、离子半径、酸性强弱等知识。

短周期元素W、X、Y的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质。根据以上叙述,下列说法中一定正确的是
| A.上述三种元素的原子半径大小为Y<X<W |
| B.W、X、Y原子的核外最外层电子数的总和为10 |
| C.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
| D.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
砷是第4周期第ⅤA族非金属元素,下列关于砷的推测不正确的是( )
| A.属于短周期元素 | B.可以存在-3、+3、+5等多种化合价 |
| C.砷在通常情况下是固体 | D.最高价氧化物As2O5属于酸性氧化物 |
下列实验操作与实验目的相符的是( )
| 序号 | 实验操作 | 实验目的 |
| A | 测定HF、HCl的熔点、沸点 | 比较F、Cl的非金属性强弱 |
| B | MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 | 比较镁、铝的金属性强弱 |
| C | 将SO2气体通入碳酸钠溶液中 | 比较碳、硫的非金属性强弱 |
| D | 向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量 | 比较NaOH、NH3·H2O、Al(OH)3的碱性强弱 |
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色固体;R是一种应用最广的金属,它的一种含氧酸根化学式为RO42-,且具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。则下列说法不正确的是( )
| A.M是离子化合物,且其溶液中阴阳离子个数比为1:l |
| B.L的悬浊液加入Q的溶液,白色沉淀可以转化为黑色沉淀 |
| C.Na2RO4水溶液可以用于杀菌消毒和净水 |
| D.Q的水溶液中加入铝与Z单质形成的化合物,只有白色沉淀生成 |
下列各组物质的性质比较中,正确的是
| A.热稳定性:H2O>HF>H2S | B.沸点:HF>HCl>HBr |
| C.密度:CH3CH2CH2Cl>CH3CH2Cl>CH3Cl | D.氧化性:Fe3+>Cu2+>H+ |
已知33As、35Br位于同一周期,下列关系正确的是 ( )
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是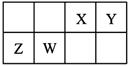
| A.Y元素最高价氧化物对应的水化物化学式为H2YO3 |
| B.原子半径由小到大的顺序为:Y<X<W<Z |
| C.室温下,Z和W的单质均能溶于浓硝酸 |
| D.X、Z两种元素的氧化物中所含化学键类型相同 |
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | 啤酒和饮料中常溶有X的最高价氧化物,打开瓶子时,这种氧化物会大量逸出 |
| Y | Y2是空气中含量最高的气体单质 |
| Z | Z的基态原子最外层电子排布式为2s22p4 |
| W | W的一种核素质量数为27,中子数为14 |
(1)W位于元素周期表第 周期第 族;Z和W的最简单的离子半径大小关系为
(用离子符号表示)
(2)一种X形成的单质,是自然界硬度最大的物质,若熔化这种单质,所需克服的微粒间的作用力是 ;Y的电负性比Z (填“大”或“小”)
(3)W的单质与NaOH溶液反应的离子方程式为 , W在高温条件下可还原高熔点的金属氧化物制的金属单质,写出W还原Cr2O3反应的化学方程式: 。
(4)煤燃烧产生的烟气中有Y的氧化物,会引起严重的环境问题,因此,常用XH4催化还原以消除污染,已知:
XH4(g)+2 YO2(g)="=" Y2(g)+ XO2(g)+2H2O (g) △H1= -867kJ/mol
2 YO2(g)
 Y2O4(g) △H2=-56.9kJ/mol
Y2O4(g) △H2=-56.9kJ/mol