题目内容
短周期元素的四种离子aW3+、bX+、cY2-、dZ- 它们的电子层结构相同,下列关系正确的是
| A.质子数c>d | B.离子的还原性Y2->Z- |
| C.氢化物的稳定性H2Y>HZ | D.原子半径X<W |
B
解析试题分析:元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,因此核外电子数相等,所以a-3=b-1=c+2=d+1。其中Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素。W、X为金属应处于第三周期,则W为Al元素,X为Na元素。A、由以上分析可知c=8,d=9,则质子数c<d, A错误;B、非金属性F>O,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,所以离子还原性Y2->Z-,故B正确;C、非金属性F>O,非金属性越强氢化物的稳定性越强,因此氢化物稳定性为HZ>H2Y,故C错误;D、W为Al元素,X为Na元素,同周期自左向右原子半径逐渐减小,则原子半径Na>Al,故D错误,答案选B。
考点:考查结构与位置关系、元素周期律的应用等

人们对原子结构的认识有一个不断深入的过程,下列先后顺序中符合史实的是( )
①道尔顿提出的原子论 ②卢瑟福的原子结构行星模型
③波尔提出的原子力学模型 ④汤姆生提出的葡萄干面包原子模型
| A.①②④③ | B.①④②③ | C.②①④③ | D.①③②④ |
下列实验操作与实验目的相符的是( )
| 序号 | 实验操作 | 实验目的 |
| A | 测定HF、HCl的熔点、沸点 | 比较F、Cl的非金属性强弱 |
| B | MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 | 比较镁、铝的金属性强弱 |
| C | 将SO2气体通入碳酸钠溶液中 | 比较碳、硫的非金属性强弱 |
| D | 向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量 | 比较NaOH、NH3·H2O、Al(OH)3的碱性强弱 |
下列各组物质的性质比较中,正确的是
| A.热稳定性:H2O>HF>H2S | B.沸点:HF>HCl>HBr |
| C.密度:CH3CH2CH2Cl>CH3CH2Cl>CH3Cl | D.氧化性:Fe3+>Cu2+>H+ |
已知33As、35Br位于同一周期,下列关系正确的是 ( )
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |
下列现象与原子核外电子跃迁无关的是
| A.激光 | B.焰火 | C.核辐射 | D.霓虹灯光 |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是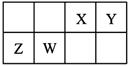
| A.Y元素最高价氧化物对应的水化物化学式为H2YO3 |
| B.原子半径由小到大的顺序为:Y<X<W<Z |
| C.室温下,Z和W的单质均能溶于浓硝酸 |
| D.X、Z两种元素的氧化物中所含化学键类型相同 |
据报道,某些建筑材料会产生放射性氡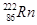 ,从而对人体产生伤害。该原子的中子数和质子数之差是
,从而对人体产生伤害。该原子的中子数和质子数之差是
| A.136 | B.50 | C.86 | D.222 |
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子最外层电子数之和与Ca2+的核外电子数相等,Y、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
| A.原子半径:Z>Y>X | B.Z与X在同一周期 |
| C.氢化物的稳定性:X>Y | D.XZ4属于共价化合物 |