题目内容
【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液b.CH3COONa 溶液c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”);
(3)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=_________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________。
【答案】 1×10-12 < 促进 c>a>b > 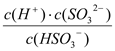 H2SO3+HCO3-=HSO3-+CO2↑+H2O
H2SO3+HCO3-=HSO3-+CO2↑+H2O
【解析】(1)①100℃时Kw(100℃)=10-6×10-6=10-12,1 mol·L-1的NaOH溶液中氢氧根浓度是1mol/L,因此由水电离出的c(H+)=10-12/1mol·L-1=10-12mol·L-1。电离吸热,加热促进水的电离,则Kw(25℃)<Kw(100℃)。②铵根水解促进水的电离。(2)①依据图表数据分析,醋酸电离常数大于氰酸大于碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度:Na2CO3溶液>NaCN溶液>CH3COONa溶液,溶液pH:Na2CO3溶液的>NaCN溶液的>CH3COONa溶液的;②等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,c(H+)<c(OH-),依据溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(CH3COO-)可知c(Na+)>c(CH3COO-);(3)①亚硫酸根电离方程式:HSO3-=H++SO32-,所以平衡常数表达式K=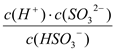 ;②因为亚硫酸的Ka2>碳酸的Ka1,所以H2SO3溶液和NaHCO3溶液反应的主要离子方程式为:H2SO3+HCO3-=HSO3-+CO2↑+H2O。
;②因为亚硫酸的Ka2>碳酸的Ka1,所以H2SO3溶液和NaHCO3溶液反应的主要离子方程式为:H2SO3+HCO3-=HSO3-+CO2↑+H2O。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案