题目内容
13.生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物.(1)乙醇是无色有特殊香味的液体,密度比水小.
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为CH2═CH2+H2O$→_{△}^{催化剂}$CH3CH2OH
(不写反应条件),原子利用率是100%.
(3)属于乙醇的同分异构体的是D(选填编号).
A.
 B.
B. C.甲醇 D.CH3-O-CH3E.HO-CH2CH2-OH
C.甲醇 D.CH3-O-CH3E.HO-CH2CH2-OH(4)乙醇能够发生氧化反应:
①46g乙醇完全燃烧消耗3 mol氧气.
②乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
分析 (1)根据乙醇的物理性质分析;
(2)乙烯中含双键可和水发生加成反应生成乙醇;
(3)根据同分异构体的概念分析;
(4)①计算出乙醇的物质的量,根据方程式分析;
②根据题给信息可知反应物和生成物,写出方程式配平即可.
解答 解:(1)乙醇的密度比水小,
故答案为:小;
(2)乙烯中含双键可和水发生加成反应生成乙醇,反应方程式为:CH2═CH2+H2O$→_{△}^{催化剂}$CH3CH2OH,从方程式可看出,反应物全部转化为生产物,原子利用率为100%,
故答案为:CH2═CH2+H2O$→_{△}^{催化剂}$CH3CH2OH;100%;
(3)分子式相同结构不同的有机物互称同分异构体,故乙醇的同分异构体为甲醚;
故答案为:D;
(4)①46g乙醇的物质的量为:$\frac{46g}{46g/mol}$=1mol,C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O,所用1mol乙醇燃烧消耗3mol氧气,
故答案为:3;
②乙醇在铜做催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查了乙醇的性质和结构,题目难度不大,注意乙醇的催化氧化为高频考点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列表示物质结构的化学用语或模型图正确的是( )
| A. | HClO的结构式:H-Cl-O | B. | 14C的原子结构示意图: | ||
| C. | 聚氯乙烯的结构简式: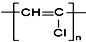 | D. | 丙烷分子的球棍模型示意图: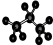 |
8.链状单炔烃完全燃烧后生成的二氧化碳与水的物质的量之比为5:4,满足上述条件的烃的种数共有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
18.下列有关元素化合物的叙述中正确的是( )
| A. | 钠在空气中燃烧生成白色的氧化钠固体 | |
| B. | 检验FeCl2溶液中的少量Fe3+,可以用KSCN溶液 | |
| C. | 二氧化硫的水溶液能使紫色石蕊溶液变红,随后使之褪色 | |
| D. | 普通玻璃的组成可用Na2O•CaO•6SiO2表示,是纯净物 |
5.a、b、c、d是原子序数依次递增的四种元素,a、b、c三种元素的原子核外电子数之和与Cl-的核外电子数相等,a、c分别得到一个电子后均形成稀有气体原子的稳定电子层结构,d是生活中用量最大的金属,其简单离子有两种常见价态,下列说法正确的是( )
| A. | 离子半径:c>b>a | |
| B. | a与c形成化合物的溶液有毒,要密封保存于玻璃瓶中 | |
| C. | a2b2与d的一种较高价态离子的盐溶液混合时会产生大量的b2 | |
| D. | d高价离子在溶液中与c的低价离子因发生氧化还原反应而不能大量共存 |
2.化学与生活密切相关,下列说法正确的是( )
| A. | 使用填埋法处理未经分类的生活垃圾 | |
| B. | “地沟油”经过加工处理后可用来制肥皂 | |
| C. | 大量使用薪柴为燃料,践行低碳生活 | |
| D. | CO2、NO2或SO2的排放是形成酸雨的主要原因 |
3.工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2•6H2O晶体,其工艺流程为:

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等).
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有漏斗、烧杯、玻璃棒.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.当pH=5时,溶液中c(Fe3+)=2.6×10-12 mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39).检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却.

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2[ | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有漏斗、烧杯、玻璃棒.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.当pH=5时,溶液中c(Fe3+)=2.6×10-12 mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39).检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却.