题目内容
4.某同学要配制1.0mol/L的NaOH溶液,提供的仪器有 ①容量瓶(250mL) ②玻璃棒 ③托盘天平(配砝码和镊子) ④药匙 ⑤胶头滴管 ⑥烧杯 ⑦漏斗(1)上述仪器中配制溶液时所需的玻璃仪器有①②⑤⑥(填序号),容量瓶上标有①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式六项中①③⑤(填序号).
(2)用托盘天平和小烧杯称取NaOH时,有下列操作步骤,正确的顺序是ACEDEB (有的操作可重复使用)
A﹒调整天平零点
B﹒将砝码放回砝码盒中,将游码拨回零刻度
C﹒称取小烧杯的质量
D﹒称取小烧杯和NaOH的质量
E﹒记录称量的数据
(3)由题意可知,你应该称取固体NaOH10.0g,如果由于称量时间过长,你所配制的NaOH溶液的浓度与要求相比偏小(填“偏大”、“偏小”或“相等”).
分析 (1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;根据容量瓶的使用特点来回答,容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量仪器,对溶液的体积精确度要求较高,只能在常温下使用;
(2)在用托盘天平称量固体时,应先调零,由于氢氧化钠固体易潮解,故称量时应放到小烧杯中,故应先称量烧杯的质量,记录数值,然后称量烧杯和氢氧化钠的质量,记录数值,将砝码放回砝码盒中,将游码拨回零刻度,据此分析;
(3)根据m=nM=CVM来计算;NaOH固体称量时间过长会潮解.
解答 解:(1)一定规格的容量瓶只能配制相应体积的溶液,容量瓶应选择250ml规格;溶液配制步骤为:一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀,所以需要的仪器为:托盘天平、药匙、烧杯、筒量(可用、也可不用)、玻璃棒、250ml容量瓶、胶头滴管,故上述仪器配制溶液时所需的玻璃仪器有:①②⑤⑥;容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量仪器,实验室常见规格有50ml、100ml、150ml、200ml、500ml等,容量瓶上标有刻度、并标有容量;容量瓶对溶液的体积精确度要求较高,只能在常温下使用,瓶上标有使用温度,一般为25℃,故应为:①③⑤;
故答案为:①②⑤⑥;①③⑤;
(2)在用托盘天平称量固体时,应先调零,即A,由于氢氧化钠固体易潮解,故称量时应放到小烧杯中,故应先称量烧杯的质量即C,然后记录下烧杯质量的数值即E,然后称量烧杯和氢氧化钠的质量即D,并记录数值即E,将砝码放回砝码盒中,将游码拨回零刻度,即B,故顺序为:ACEDEB,故答案为:ACEDEB;
(3)所需的氢氧化钠的质量m=nM=CVM=1mol/L×0.25mol/L×40g/mol=10.0g;NaOH固体称量时间过长会潮解,所配制的NaOH溶液的浓度与要求相比会偏小,故答案为:10.0g;偏小.
点评 本题考查了配制一定物质的量浓度的溶液的方法,题目难度中等题,注意掌握配制一定物质的量浓度的溶液的方法,明确误差分析的方法与技巧,试题基础性强,贴近高考,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练.

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案| A. | -16Q kJ/mol | B. | +8Q kJ/mol | C. | +16 Q kJ/mol | D. | -8 Q kJ/mol |
| A. | 氯气通入氢氧化钠溶液中 Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 金属铁与稀硝酸反应 Fe+2H+=Fe2++H2↑ | |
| C. | 在硅酸钠溶液中滴加稀硫酸 SiO32-+2H+=H2SO3↓ | |
| D. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-=Cu2++SO2↑+2H2O |

| A. | Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗 | |
| B. | Ⅱ图中:量筒中发生了加成反应 | |
| C. | Ⅲ图中:生成蓝色的烟 | |
| D. | Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
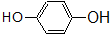 ③
③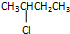
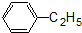 ⑤
⑤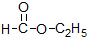 ⑥
⑥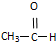
 研究性学习小组进行CH4的性质探究实验.
研究性学习小组进行CH4的性质探究实验. B.
B. C.甲醇 D.CH3-O-CH3E.HO-CH2CH2-OH
C.甲醇 D.CH3-O-CH3E.HO-CH2CH2-OH 2-甲基-6-乙基壬烷
2-甲基-6-乙基壬烷 4,7,7-三甲基-1-辛烯
4,7,7-三甲基-1-辛烯