题目内容
(1)常温下pH="5" HCl溶液和pH=5的AlCl3溶液中由水电离产生的c (H+) 之比等于 。
(2)写出泡沫灭火器灭火时发生反应的离子方程式 。
(3)常温下将0.01molCH3COONa和0.02mol盐酸溶于水,配成0.5L混合溶液。溶液中共有 种微粒,各离子浓度从大到小的顺序为 。
(4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(忽略溶液混合时的体积变化)。
回答下列问题:
①由图中信息可知HA为_______酸(填“强”或“弱”) ② K点对应的溶液中c(M+)+c(MOH)= mol·L-1。
(1) 10-4:1或1:104; (2)Al3++3HCO3-=Al(OH)3↓+3CO2↑
(3) 7;C(Cl-)>C(H+)>C(Na+)>C(CH3COO-)>C(OH-);(4) ①强 ②0.01
解析试题分析:(1)常温下pH="5" HCl的溶液,C(H+)=10-5mol/L,C(OH-)= C(H+)(水)=10-9mol/L, pH=5的AlCl3溶液C(H+)(水)=10-5mol/L 。所以二者由水电离产生的c (H+) 之比等于10-9mol/L:10-5mol/L=10-4:1=1:104. (2)泡沫灭火器灭火时发生反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑(3)常温下将0.01molCH3COONa和0.02mol盐酸溶于水,配成0.5L混合溶液。溶液中共有H2O、CH3COOH、H+、Cl-、CH3COO-、Na+、 OH-七种微粒。HCl+CH3COONa= CH3COOH+NaCl.n(Na+)=0.01mol,n(Cl-)=0.02mol,由于CH3COOH的电离作用大于CH3COO-的水解作用,所以n(CH3COOH)>0.01mol, n(CH3COO-) < 0.01mol.n(H+)>n(OH-).各离子浓度从大到小的顺序为C(Cl-)>C(H+)> C(Na+)>C(CH3COO-)> C(OH-).(4) 100 mL 0.01 mol·L-1HA与51ml的0.02 mol·L-1MOH溶液混合溶液恰好为中性,说明HA为强酸,MOH为弱碱。K点对应的溶液中c(M+)+c(MOH)="(" 0.02 mol/L×0.1L)÷0.2L=0.01mol/L.
考点:考查酸溶液、盐溶液中水的电离、溶液中离子浓度的比较、泡沫灭火器的原理等知识。

(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):n(HSO3﹣) | 91 :9 | 1 :1 | 1 :91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显 性,从原理的角度解释原因
②在NaHSO3溶液中离子浓度关系不正确的是(选填字母):
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生 。再生示意图如下:
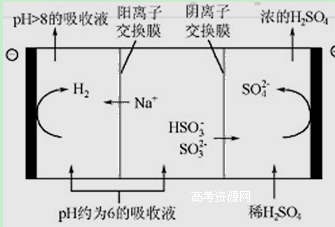
① 吸收液再生过程中的总反应方程式是 。
② 当电极上有1mol电子转移时阴极产物为 克.
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
| A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) | B.c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D.c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
② 若为HCl 和NH4Cl 混合溶液,则四种离子浓度的由大到小的顺序是_________;
若为NH3· H2O 和NH4Cl 混合溶液,四种离子浓度的由大到小的顺序是__________。
③ 若该溶液是由体积相等的HCl溶液和氨水混合而成,且恰好呈中性,则混合前c(HCl) _____c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(OH-)____c(NH4+)。
常温下有0. 1 mol/L的以下几种溶液,①H2SO4溶液②NaHSO4溶液③CH3COOH溶液④HCl溶液⑤HCN溶液⑥NH3·H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:
| ①H2SO4溶液HSO4- | ②NaHSO4溶液HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
(1)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是(填序号,下同) _
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温
同压下)由大到小的顺序是_ _
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH应选用_ 作指示剂,若终点时溶液pH = a,则由水电离的。c(H+)为_ 。
(4)在25℃时,将b mol·L-1的KCN溶液与0. O1 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH = 7,则KCN溶液的物质的量浓度b_ 0.01 mol·L-1填“>”、“<”或“=”);用含b的代数式表示HCN的电离常数Ka=
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=___________mol·L-1。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
c(CH3COO-)(填“>”、“<”或“=”)。
②25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为___________。(填序号)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________________________________。
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H+ + S042-。
H+ + S042-。
请回答下列有关问题:
(1)Na2SO4溶液呈_(填“弱酸性”、“中性”或“弱碱性”),其理由是_
(用离子方程式表示)。
(2)H2SO4溶液与BaC12溶液反应的离子方程式为_ 。
(3)在0.l0mol·L-1的Na2SO4溶液中,下列离子浓度关系正确的是_ (填写编号)。
| A.c(Na+)=c(SO42-)+c(HSO4一)+c(H2SO4) |
| B.c(OH-)="c(" HSO4-)+c(H+) |
| C.c( Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D.c( Na+)=2c(SO42-)+2c(HSO4-) |
(5)若25℃时,0.10 mol·L-1H2SO4溶液的pH=-lg0.11,则0.10 mol·L-1的H2SO4溶液中c(SO42-)= mol·L-1
 H++A2-。
H++A2-。 H++HA-,HA-
H++HA-,HA- H++OH? ,请回答:
H++OH? ,请回答: