题目内容
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=___________mol·L-1。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
c(CH3COO-)(填“>”、“<”或“=”)。
②25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为___________。(填序号)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________________________________。
(1)1×10-12促进 (2)>;②>①>③;②>③;NaCN+H2O+CO2=HCN+NaHCO3
解析试题分析:(1)100℃时根据图像可知,水的离子积常数等于10-12,所以100℃时1 mol·L-1的NaOH溶液中,OH-浓度是1mol·L-1,则氢离子的浓度=1×10-12mol/L,因此溶液中由水电离出的c(H+)=1×10-12mol/L;氯化铵溶于水NH4+水解,促进水的电离,因此25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进。
(2)①25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,二者恰好反应生成醋酸钠。由于所得溶液显碱性,这说明溶液中CH3COO-水解,因此溶液中则c(Na+)>c(CH3COO-)。
②弱酸的电离平衡常数越大,酸性越强。则根据电离平衡常数可知,酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO3-。又因为酸性越弱,相应的钠盐越容易水解,溶液的碱性越强,因此25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为②>①>③。
③酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO3-,则根据较强酸制备较弱酸的原理可知,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3。
考点:考查离子积常数、水的电离、溶液中离子浓度大小比较、盐类水解以及电离平衡常数的应用

某同学用工业硫酸铜(含硫酸亚铁等杂质)制备纯净的CuSO4·5H2O。工艺流程如下
(部分操作和条件略):
I.取工业硫酸铜固体,用稀硫酸溶解,过滤。
II.向滤液中滴加H2O2溶液,稍加热。
III.向II的溶液中加入CuO粉末至pH=4。
IV.加热煮沸,过滤,滤液用稀硫酸酸化至pH=1。
V.蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得晶体。
已知部分阳离子生成氢氧化物的pH、Ksp(25℃)如下表:
| 物质 | Fe(OH)3 | Fe (OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀时pH | 3.7 | 9.6 | 6.7 |
| Ksp | 4.0×10–38 | 8.0×10–16 | 2.2×10–20 |
(1)II中发生反应的离子方程式是 。
(2)II中将Fe2+氧化为Fe3+的目的是 。
(3)用K3[Fe(CN)6](铁氰化钾)验证II中Fe2+是否转化完全的现象是 。
(4)III中发生反应的离子方程式是 。
通过计算说明在此条件下的溶液中Fe3+是否沉淀完全________________________(提示:当溶液中某离子浓度小于1.0×10–5 mol/L时可认为该离子沉淀完全)。
(5)应用化学平衡移动原理解释IV中“滤液用稀硫酸酸化”的原因 。
常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8. 8 | 9. 7 | 11. 6 | 10. 3 | 11. 1 | 11. 3 |
(2)NaAlO2溶液呈碱性的原因是 (用离子方程式表示)。将溶液加热蒸干最后得到的固体产物是 ;
(3)结合表中数据分析, 与0. 1 mol/L的CH3COONa溶液中水的电离程度相同的有 (填字母代号)。
A.pH="8." 8的NaOH溶液 B. pH="5." 2的NH4Cl溶液 C.pH="5." 2的盐酸
D. 0. 1 mol/L的NaCN溶液 E.pH="8." 8的Na2CO3溶液
(4)将浓度均为0. 1 mol/L的b、c等体积混合, 所得溶液中各离子浓度关系正确的有 。
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B. 2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C. c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D. c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
(5)0.2 mol/LHCl与0.1 mol/L NaAlO2溶液等体积混合溶液后离子浓度顺序为 。
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)写出醋酸的电离方程式: 。
(2)醋酸溶液中存在的微粒有 。
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是 。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度(填增大、减小或不变) 。
(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示95 ℃时水的电离达平衡时的离子浓度。则95℃时0.1 mol·L-1的NaOH溶液中,由水电离出的 c(H+)= mol·L-1,Kw(25 ℃) Kw(95℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl 固体,对水的电离平衡的影响是 (填“促进”、“抑制”或“不影响”)。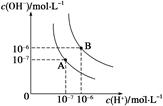
(2)25℃时,在0.1L 0.2 mol·L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= ,电离度为 。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量(已知如表数据)。向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
| 化学式 | 电离平衡常数(25 ℃) |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25℃时,某NaCl溶液中c(Cl–)=1×10-4 mol·L–1,则该溶液中c(Na+)∶c(OH-)=
(2)25℃时,将0.1 mol·L–1NaOH溶液与0.06 mol·L–1的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH= 。25℃时,pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近 。
(3)25℃时,下列四种溶液中,①pH=0的盐酸 ②0.1 mol·L–1的盐酸 ③0.01 mol·L–1的NaOH溶液 ④pH=11的NaOH溶液,由水电离生成氢离子浓度之比①︰②︰③︰④是: (填字母)
| A.1︰10︰100︰1000 | B.0︰1︰12︰11 |
| C.14︰13︰12︰11 | D.14︰13︰2︰3 |
①则该温度下水的Kw= 。
②在该温度下测得某溶液pH=3,则该溶液中c(H+)∶c(OH-)=________。
③该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,pH=______________
(5) 纯水中c(H+)=5.0×10–7 mol·L–1,则此时纯水中的c(OH–) = ;若温度不变,滴入稀硫酸使c(H+)=5.0×10–3 mol·L–1,则c(OH–) = ;在该温度时,往水中滴入NaOH溶液,溶液中的c(OH–)=5.0×10–2 mol·L–1,则溶液中c(H+)= 。

