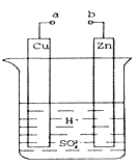
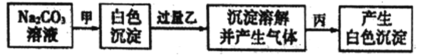
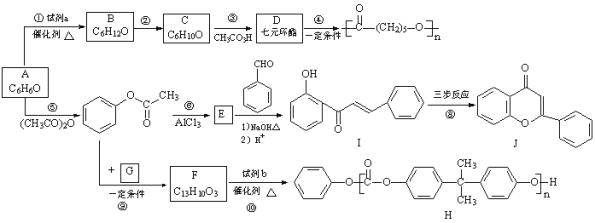
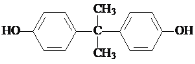
��Ŀ����
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ�~����Ԫ�أ��ش��������⣺
�������� | I A | II A | III A | IV A | V A | VI A | VII A | 0�� |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
4 | �� | �� |
(1)Ԫ�آٵ�������______��Ԫ�آ������ڱ�������λ��________��
(2)Ԫ�آڵļ��⻯��ĽṹʽΪ________��
(3)�õ���ʽ��ʾԪ�آ���ߵĻ�������γɹ��̣�__________________��
(4)��ʾ����ᰴԭ�Ӹ�����1:1�γɵĻ�����ĵ���ʽ��______���û������к��еĻ�ѧ��������______��
(6)�ܡ��ޡ��ߡ�������Ԫ���γɵļ����ӣ����Ӱ뾶�ɴ�С��˳����_____(�������ӷ��ű�ʾ)��
���𰸡��� �ڶ����ڵ�IVA�� ![]()
![]()
![]() ���ۼ������Ӽ� H2O>NH3>H2S S2->Cl->K+>O2-
���ۼ������Ӽ� H2O>NH3>H2S S2->Cl->K+>O2-
��������
����Ԫ�����ڱ��Ľṹ������֪�����еĢ�~����Ԫ�طֱ�Ϊ��B��C��N��O��Mg��S��Cl��Ar��K��Br��Ȼ���������Ľ���Ͳ������ˡ�
(1)�ɱ��п�֪Ԫ�آٵ���������Ԫ�آ������ڱ�������λ��Ϊ�ڶ����ڵ�IVA�壬�ʴ�Ϊ���� �ڶ����ڵ�IVA�壻
(2)Ԫ�آڵļ��⻯�TCH4�ĽṹʽΪ![]() ���ʴ�Ϊ
���ʴ�Ϊ![]() ��
��
(3)�õ���ʽ��ʾԪ�آ���ߵĻ����TMgCl2�����γɹ����õ���ʽ��ʾ���£�![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4)��ʾ����ᰴԭ�Ӹ�����1:1�γɵĻ����TNa2O2�ĵ���ʽΪ![]() ���û������к��еĻ�ѧ�������Ӽ��ͷǼ��Լ����ʴ�Ϊ��
���û������к��еĻ�ѧ�������Ӽ��ͷǼ��Լ����ʴ�Ϊ��![]() ���Ӽ��ͷǼ��Լ���
���Ӽ��ͷǼ��Լ���
(5)Ԫ�آۢܢ��γɵ��⻯��ֱ�ΪNH3��H2O��H2S������H2O����֮�����γ�2�������NH3����֮�����γ�һ�������H2S����֮�䲻���γ�����������Ƿе��ɸߵ���˳��Ϊ��H2O>NH3>H2S ���ʴ�Ϊ��H2O>NH3>H2S��
(6)�ܡ��ޡ��ߡ�������Ԫ���γɵļ����ӷֱ���O2-��S2-��Cl-��K+��O2-�������������Ӳ㣬��S2-��Cl-��K+�ĺ�������Ų���ȫ��ͬ�����ź˵�������������Ӱ뾶��С�����������Ӱ뾶�ɴ�С��˳����S2->Cl->K+>O2-���ʴ�Ϊ��S2->Cl->K+>O2-��

����Ŀ�������仯�����ǿ�ѧ����һֱ��̽�������⣬�����ڹ�ũҵ�������������������Ҫ�����á��ش��������⡣
��.��֪H��H���ļ���Ϊa kJ��mol-1��N��H���ļ���ΪbkJ��mol-1��N![]() N���ļ�����ckJ��mol-1����ӦNH3(g)
N���ļ�����ckJ��mol-1����ӦNH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)����H=____kJ��mol-1������ij�¶�����ƽ�ⳣ��ΪK����N2(g)+3H2(g)
H2(g)����H=____kJ��mol-1������ij�¶�����ƽ�ⳣ��ΪK����N2(g)+3H2(g)![]() 2NH3(g)��ƽ�ⳣ��K1=____����K��ʾ����
2NH3(g)��ƽ�ⳣ��K1=____����K��ʾ����
��.һ�Ȱ������Ȱ������Ȱ�(NH2Cl��NHCl2��NCl3)�dz��õ�����ˮ������������
��1����Cl2��NH3��Ӧ�Ʊ����Ȱ��ķ���ʽΪ3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g)�����ݻ���Ϊ1L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T�棩�����зֱ����2molCl2��2molNH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
NCl3(l)+3HCl(g)�����ݻ���Ϊ1L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T�棩�����зֱ����2molCl2��2molNH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
t/min | 0 | 40 | 80 | 120 | 160 |
�ף�400�棩n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
�ң�T�棩n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
��T��___400�棨�>����<�������÷�Ӧ����H___0���>����<������
�ڸ÷�Ӧ�Է��е�������____������¡����¡��κ��¶ȣ���
�۶Ը÷�Ӧ������˵����ȷ����___����ѡ����ĸ����
A���������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬
B����������Cl2��NH3���ʵ���֮��Ϊ3��1���������Ӧ�ﵽƽ��״̬
C����Ӧ��ƽ��������������䣬����һ������NCl3��ƽ�⽫���淴Ӧ�����ƶ�
D����Ӧ�ﵽƽ��������������䣬��ԭ�����а�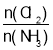 =1��������һ������Ӧ�����ƽ���Cl2��ת��������
=1��������һ������Ӧ�����ƽ���Cl2��ת��������
��2����ҵ�Ͽ����÷�Ӧ2Cl2(g)+NH3(g)![]() NHCl2 (l)+2HCl(g)�Ʊ����Ȱ���
NHCl2 (l)+2HCl(g)�Ʊ����Ȱ���
��NHCl2�����ԡ����Ի����лᷢ��ǿ��ˮ�⣬���ɾ���ǿɱ�����õ����ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ____��
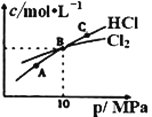
���ں��������£���2molCl2��1molNH3����ij�ܱ������з���������Ӧ�����ƽ��ʱCl2��HCl�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ����A��B��C������Cl2ת������ߵ���___�㣨�A����B����C������B��ʱ��Ӧ��ת���ʣ���(Cl2)___��(NH3)���>����=����<��������B��ƽ�����Ϊ2L����ƽ�ⳣ��K=____��