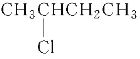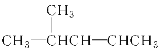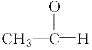题目内容
【题目】下列表示氮原子结构的化学用语中,对核外电子运动状态描述正确且能据此确定电子能级的是( )
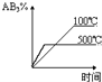
A.![]() B.
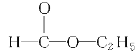
B.![]() C.1s22s22p3D.
C.1s22s22p3D.![]()
【答案】C
【解析】
A. 是N原子的原子结构示意图,只能看出在原子核外各个电子层上含有的电子数的多少,不能描述核外电子运动状态,故A错误;
B. 是N原子的电子式,可以得到原子的最外电子层上有5个电子,不能描述核外电子运动状态,故B错误;
C. 是N原子的核外电子排布式,不仅知道原子核外有几个电子层,还知道各个电子层上有几个电子亚层,及核外电子运动状态,故C正确;
D. D是N原子的轨道表示式,但原子核外的电子总是尽可能的成单排列,即在2p的三个轨道上各有一个电子存在,且自旋方向相同,这样的排布使原子的能量最低,故D错误。
故选C。

【题目】某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
实验序号 | 加入试剂 | 实验现象 |
Ⅰ | 4 mL 2 mol·L-1HCl 溶液 | 沉淀溶解 |
Ⅱ | 4 mL 2 mol·L-1NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程_____________。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因___________。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是_________。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是____________。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是___________。
③乙同学这样配制混合溶液的理由是___________。