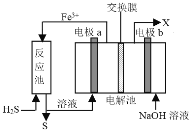
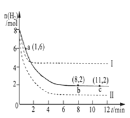
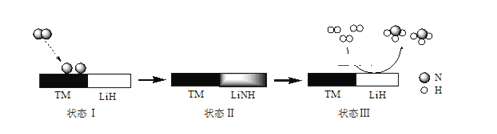
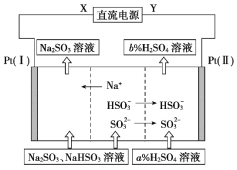
题目内容
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据),根据下图回答下列问题:
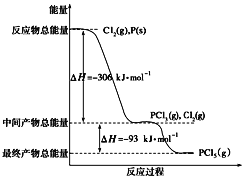
(1)PCl5分解生成PCl3和Cl2的热化学方程式__________________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8 mol PCl5,反应达到平衡时生成标准状况下4.48LCl2,其分解率a1为_________;若反应温度由T1升高到T2,平衡时PCl5的分解率a2,a2______a1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是__________________________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________。
【答案】PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJmol1 25% 大于 两步反应均为放热反应,降低温度有利于提高产率,防止产物分解 399kJmol1
【解析】
⑴根据图像可知PCl3和Cl2反应生成1molPCl5放出93kJ的热量;计算平衡时Cl2的物质的量,得到PCl5消耗的物质的量,再计算分解率;若反应温度由T1升高到T2,升高温度,平衡向吸热反应方向移动即正向移动。
⑵工业上制备PCl5的两步反应都是放热反应,先将P和Cl2反应生成中间产物PCl3,PCl3和Cl2反应,降温有利于平衡正向移动生成PCl5,防止PCl5分解。
⑶P和Cl2分两步反应生成1 mol PCl5的ΔH3即为两步反应的焓变相加。
⑴根据图像可知PCl3和Cl2反应生成1molPCl5放出93kJ的热量,因此PCl5分解生成PCl3和Cl2的热化学方程式PCl5(g) = PCl3(g) + Cl2(g) △H= + 93kJmol1;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8 mol PCl5,反应达到平衡时生成标准状况下4.48LCl2即物质的量为0.2mol,根据方程式关系,说明消耗0.2 mol PCl5,其分解率为![]() ;若反应温度由T1升高到T2,升高温度,平衡向吸热反应方向移动即正向移动,转化率增大,因此平衡时PCl5的分解率a2大于a1;故答案为:25%;大于。
;若反应温度由T1升高到T2,升高温度,平衡向吸热反应方向移动即正向移动,转化率增大,因此平衡时PCl5的分解率a2大于a1;故答案为:25%;大于。
⑵工业上制备PCl5通常分两步进行,这两步都是放热反应,先将P和Cl2反应生成中间产物PCl3,PCl3和Cl2反应,降温有利于平衡正向移动生成PCl5,防止PCl5分解;故答案为:两步反应均为放热反应,降低温度有利于提高产率,防止产物分解。
⑶P和Cl2分两步反应生成1 mol PCl5的ΔH3即为两步反应的焓变相加,因此ΔH3=(306kJmol1) + (93kJmol1) = 399kJmol1;故答案为:399kJmol1。

【题目】对下列现象或事实的解释正确的是( )
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液去除油污 | 纯碱与油污直接发生反应,生成易溶于水的物质 |
B | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
C | 漂白粉在空气中久置变质 | 漂白粉中的ClO-可以水解成HClO |
D | FeCl3溶液可用于水处理 | FeCl3中Fe3+具有氧化性可杀菌消毒 |
A.AB.BC.CD.D