题目内容
【题目】在0.5L某刚性密闭容器中,充入2molCO和1molNO2,在一定条件下发生反应:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)。2min时该反应达到平衡,反应前后容器内压强比为12:11。下列判断错误的是( )
4CO2(g)+N2(g)。2min时该反应达到平衡,反应前后容器内压强比为12:11。下列判断错误的是( )
A.N2的平衡浓度为0.5mol·L-1
B.2min内NO2的平均反应速率为0.25mol·L-1·min-1
C.反应任意时刻CO和NO2的转化率均相等
D.平衡后再向容器中充入2molCO和1molNO2,再次平衡后,CO的转化率大于50%
【答案】B
【解析】
相同条件下,气体的压强之比等于物质的量之比,设平衡时转化CO的物质的量为xmol,则列三段式有:
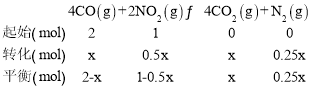
则![]() ,解得x=1mol。
,解得x=1mol。
A.N2的平衡浓度为![]() ,故A正确;
,故A正确;
B.2min内NO2的平均反应速率为![]() =0.5molL-1min-1,故B错误;
=0.5molL-1min-1,故B错误;
C.充入2mol CO和1mol NO2,且按2:1反应,则反应任意时刻CO和NO2的转化率均相等,故C正确;
D.平衡时,CO的转化率为![]() ×100%=50%,平衡后再向容器中充入2mol CO和1mol NO2,若达到等效平衡则转化率不变,但该反应中反应物气体系数之和大于生成物气体系数之和,相当于增大压强,平衡正向移动,则CO的转化率大于50%,故D正确。
×100%=50%,平衡后再向容器中充入2mol CO和1mol NO2,若达到等效平衡则转化率不变,但该反应中反应物气体系数之和大于生成物气体系数之和,相当于增大压强,平衡正向移动,则CO的转化率大于50%,故D正确。
故选:B。

【题目】含有Cu、Fe、Al、Co、Li、Si等成分的某合金废料回收利用的工艺流程如图所示。
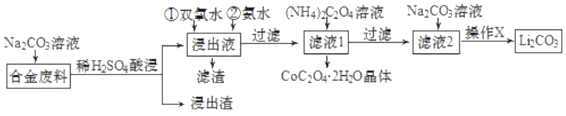
已知:
①Fe、Co在周期表中属同周期、同族;常温下,pH=7.3时Li+或Co3+开始沉淀。
②有关物质的溶度积(Ksp):
物质 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Ksp | 4.0×10-21mol3·L-3 | 1.0×10-32mol4·L-4 | 1.0×10-38mol4·L-4 | 8.0×10-19mol3·L-3 |
回答下列问题
(1)Na2CO3溶液可作为合金废料的油污除剂,用离子方程式表示其原理__。
(2)“浸出渣”中的物质为__。
(3)①“浸出液”加入双氧水的作用是__(用离子方程式表示)。
②氨水的作用是调节溶液的pH,常温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol·L-1认为完全沉淀)。需调节溶液的pH范围为__。
(4)得到的CoC2O4·2H2O晶体在空气中充分焙烧可得Co2O3,化学方程式为__。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度的关系如表所示。
温度/℃ | 10 | 30 | 60 |
浓度/(mol·L-1) | 0.21 | 0.17 | 0.14 |
则操作X为蒸发浓缩、__,理由是__。
【题目】对下列现象或事实的解释正确的是( )
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液去除油污 | 纯碱与油污直接发生反应,生成易溶于水的物质 |
B | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
C | 漂白粉在空气中久置变质 | 漂白粉中的ClO-可以水解成HClO |
D | FeCl3溶液可用于水处理 | FeCl3中Fe3+具有氧化性可杀菌消毒 |
A.AB.BC.CD.D