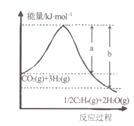
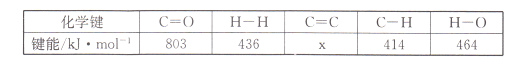
题目内容
【题目】某小组为研究电化学原理,设计如图装置。下列叙述正确的是

A. a和b不连接时,铁片上不会有金属铜析出
B. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
C. a和b用导线连接时,电流方向从b到a
D. a和b用导线连接时,Fe片上发生氧化反应,溶液中SO42-向铜电极移动
【答案】B
【解析】
A.由于金属活动性Fe>Cu,所以a和b不连接时,铁片上发生反应:Fe+CuSO4=FeSO4+Cu,所以Fe片上会有金属铜析出,A错误;
B.若a、b不连接,在Fe片上会发生反应Fe+CuSO4=FeSO4+Cu,铁片均会溶解,溶液从蓝色逐渐变成浅绿色;若a、b连接,构成原电池,在Fe片上发生反应:Fe-2e-=Fe2+,在Cu片上发生反应:Cu2++2e-=Cu,总反应方程式Fe+Cu2+=Fe2++Cu,看到的仍然是铁片均会溶解,溶液从蓝色逐渐变成浅绿色,B正确;
C.若a和b用导线连接时,构成原电池,由于金属活动性:Fe>Cu,所以Fe为负极,失去电子,因此电子从b到a,而电流方向从a到b,C错误;
D. a和b用导线连接时,Fe片为负极,失去电子发生氧化反应,溶液中SO42-向正电荷较多的负极铁电极移动,D错误;
故合理选项是B。

【题目】已知七种短周期元素a~g的有关信息如下表所示:
元素编号 | a | b | c | d | e | f | g |
原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
最高化合价或最低化合价 | +1 | ﹣2 | +3 | ﹣2 | +3 | +1 | +1 |
下列推断不正确的是( )
A. 氢化物稳定性的强弱:b>dB. 金属性的强弱:f<g
C. 元素e的氧化物只能与酸反应D. 元素a与元素d形成的化合物属于共价化合物
【题目】已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 | H2SO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
(1)25℃时,将20mL 0.1mol·L-1CH3COOH溶液和20mL 0.1mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:__________________________
(2)若保持温度不变,在CH3COOH溶液中加入一定量氨气,下列量会变小的是____(填序号)
A.c(CH3COO-) B.c(H+)C.Kw D.醋酸电离平衡常数
(3)若保持温度不变,将pH均为3的HCl与HSCN的溶液分别加水稀释100倍,此时c(Cl-)_____c(SCN-) (填“>、=、<”,后同),两溶液的导电性:HCl _______HSCN
(4)将足量的NaHSO3溶液加入Na2CO3溶液中,反应的离子方程式为___________________________