题目内容
【题目】下列有关说法正确的是
A. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)将减小
B. 一定温度下,反应“2HI(g)![]() H2(g)+I2(g) △H>0”能自发进行,则该反应△S>0
H2(g)+I2(g) △H>0”能自发进行,则该反应△S>0
C. 向滴有酚酞的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去,说明BaCl2溶液显酸性
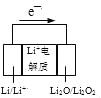
D. 上图电池放电时的正极反应式:2Li++Li2O2+2e—=2Li2O
【答案】BD
【解析】试题A.Mg(OH)2的悬浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),当向其中加入少量的NH4Cl固体时,发生反应:NH4++ OH-=NH3H2O,由于c(OH-)减小,所以沉淀溶解平衡正向移动,使c(Mg2+)增大,错误;B.一定温度下,反应“2HI(g)
Mg2+(aq)+2OH-(aq),当向其中加入少量的NH4Cl固体时,发生反应:NH4++ OH-=NH3H2O,由于c(OH-)减小,所以沉淀溶解平衡正向移动,使c(Mg2+)增大,错误;B.一定温度下,反应“2HI(g)![]() H2(g)+I2(g) △H>0”能自发进行,根据体系的自由能公式:△G=△H-T△S<0,则该反应△S>0,正确;C.Na2CO3是强碱弱酸盐,在溶液中存在水解平衡: CO32-+H2O
H2(g)+I2(g) △H>0”能自发进行,根据体系的自由能公式:△G=△H-T△S<0,则该反应△S>0,正确;C.Na2CO3是强碱弱酸盐,在溶液中存在水解平衡: CO32-+H2O![]() HCO3-+OH-,溶液显碱性,所以滴有酚酞溶液变为红色,当向其中滴加BaCl2溶液时,发生反应:CO32-+Ba2+=BaCO3↓,消耗了CO32-,水解平衡逆向移动,c(OH-)减小,红色逐渐褪去,因此不能说BaCl2溶液显酸性,错误。D.根据图示可知在电池放电时的正极Li2O2得到电子变为Li2O,电极反应式是:2Li++Li2O2+2e—=2Li2O,正确。
HCO3-+OH-,溶液显碱性,所以滴有酚酞溶液变为红色,当向其中滴加BaCl2溶液时,发生反应:CO32-+Ba2+=BaCO3↓,消耗了CO32-,水解平衡逆向移动,c(OH-)减小,红色逐渐褪去,因此不能说BaCl2溶液显酸性,错误。D.根据图示可知在电池放电时的正极Li2O2得到电子变为Li2O,电极反应式是:2Li++Li2O2+2e—=2Li2O,正确。

练习册系列答案
相关题目