题目内容
【题目】已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 | H2SO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
(1)25℃时,将20mL 0.1mol·L-1CH3COOH溶液和20mL 0.1mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:__________________________
(2)若保持温度不变,在CH3COOH溶液中加入一定量氨气,下列量会变小的是____(填序号)
A.c(CH3COO-) B.c(H+)C.Kw D.醋酸电离平衡常数
(3)若保持温度不变,将pH均为3的HCl与HSCN的溶液分别加水稀释100倍,此时c(Cl-)_____c(SCN-) (填“>、=、<”,后同),两溶液的导电性:HCl _______HSCN
(4)将足量的NaHSO3溶液加入Na2CO3溶液中,反应的离子方程式为___________________________
【答案】相同温度下HSCN比CH3COOH电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3 溶液反应快 B < < HSO3- + CO32- =SO32- + HCO3-
【解析】
(1).相同温度下,等浓度酸的强弱不同,c(H+)不同,因Ka(HSCN)>Ka(CH3COOH),所以酸性HSCN>CH3COOH,等浓度的两种酸溶液中c(H+):HSCN>CH3COOH,c(H+)越大,反应速率越快,故答案为:相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快;
(2). A.若保持温度不变,在CH3COOH溶液中加入一定量氨气,氨气与醋酸反应生成醋酸铵,溶液中c(CH3COO)增大,故A不选;
B. 在CH3COOH溶液中加入一定量氨气,氨气与醋酸反应,溶液的酸性减弱,c(H+)减小,故B选;
C. 温度不变则Kw不变,故C不选;
D. 温度不变,则醋酸电离平衡常数不变,故D不选,答案选B;
(3). HCl是强电解质,在水溶液中完全电离,HCl溶液中c(Cl)= c(H+),HSCN是弱电解质,在水溶液中部分电离,HSCN溶液中c(SCN )= c(H+),保持温度不变,将pH均为3的HCl与HSCN的溶液分别加水稀释100倍,HCl溶液中c(Cl)= c(H+)=105mol/L,稀释促进HSCN的电离,HSCN溶液中c(SCN )= c(H+)>105mol/L,所以c(Cl)<c(SCN ),溶液中离子浓度越大,溶液的导电性越强,所以两溶液的导电性:HCl <HSCN,故答案为:<;<;
(4).相同条件下,酸的电离常数越大,其酸性越强,由表中数据可知,酸性:H2CO3>HSO3>HCO3,则将足量的NaHSO3溶液加入Na2CO3溶液中,反应生成Na2SO3和NaHCO3,离子方程式为HSO3- + CO32- =SO32- + HCO3-,故答案为:HSO3- + CO32- =SO32- + HCO3-。

 优等生题库系列答案
优等生题库系列答案【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。实验药品:铜、铁、镁、0.5 mol L-1H2SO4溶液、2 mol L-1 H2SO4溶液。甲同学研究的实验报告如下表∶
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol L-1 的硫酸溶液于三支试管中 | 反应速率∶ 镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
(1) 甲同学表中实验步骤②为______________________。
(2) 甲同学的实验目的是__________________________。
要得出正确的实验结论,还需要控制的实验条件是_____________。
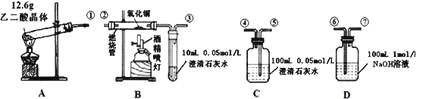
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行实验∶

(3)乙同学在实验中应该测定的数据是_________________。
(4)乙同学完成该实验应选用的实验药品是________________。