题目内容
9.下列关于铜的说法中,不正确的是( )| A. | 铜是一种紫红色金属 | |
| B. | 铜是热和电的良导体 | |
| C. | 铜是人类使用最早、应用最广泛的金属之一 | |
| D. | 铜在自然界中主要以单质的形式存在 |
分析 铜是金属,具有金属的通性,导电、导热、延展性,是一种紫红色金属,自然界中铜以化合态和游离态两种形式存在,铜的化学性质不活泼,金属大规模被使用的先后顺序跟金属的活动性关系最大,金属活动性较弱时,比较难形成化合物,常以单质形式存在,比较容易被利用,金属的活动性越强,就越难把它制成单质,所以在科技不发达的时候,难以被利用;另外,金属能否被广泛应用,还与它们在地壳中的含量有关,含量越大,越容易被发现.
解答 解:A、铜呈紫红色光泽的金属,一种紫红色金属,故A正确;
B、铜是金属,具有金属的通性,导电、导热、延展性,铜是热和电的良导体,故B正确;
C、由于铜的活动性比较弱,以单质形式存在的比较多,在我国,距今4000年前的夏朝已经开始使用红铜,即天然铜,铜是人类使用最早、应用最广泛的金属之一,故C正确;
D、自然界中铜主要以化合态形式存在,故D错误;
故选D.
点评 本题考查了铜性质的分析应用,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.某有机化合物(简称EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
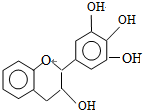

| A. | 分子式为C15H12O5 | |
| B. | 1molEGC与5molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,不能发生消去反应 | |
| D. | 遇FeCl3溶液能发生显色反应 |
4.下列物质中,既有离子键,又有共价键的是( )
| A. | CaCl2 | B. | Na2O | C. | H2SO4 | D. | NH4Cl |
14.向一密闭容器中充入1mol N2和3mol H2,在一定条件下反应.下列叙述中,能说明上述反应达到化学平衡状态的是( )
| A. | 容器内混合气体的密度不随时间的变化而变化 | |
| B. | 单位时间内每消耗3mol H2,同时生成2mol NH3 | |
| C. | 混合气体的总质量不随时间的变化而变化 | |
| D. | 混合气体的总物质的量不随时间的变化而变化 |
18.C、N、O、Al、Fe、Cu是常见的六种元素.
(1)Fe位于元素周期表的第四周期第ⅤⅢ族,Cu的基态原子价电子排布式为3d104s1,
Al原子的基态原子核外有13种运动状态不同的电子.
(2)用“>”或“<”填空:
(3)10g铁放在40mL硝酸溶液中,微热,充分反应后收集到1.792L(标准状况)混合
气体(NO2、NO),溶液中残留4.4g固体.写出上述反应的总的化学方程式5Fe+14HNO3$\frac{\underline{\;\;△\;\;}}{\;}$5Fe(NO3)2+NO2↑+3NO↑+7H2O.
(4)Fe(s)+O2(g)=FeO(s)△H=-272.0kJ/mol
Al(s)+O2(g)=Al2O3(s)△H=-1675.7kJ/mol
Al的单质和FeO反应的热化学方程式是2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1.
(1)Fe位于元素周期表的第四周期第ⅤⅢ族,Cu的基态原子价电子排布式为3d104s1,
Al原子的基态原子核外有13种运动状态不同的电子.
(2)用“>”或“<”填空:
| 电负性 离子半径 键的极性 | 熔点 |
| N<O O2->Al3+ C-H<H-O | Al<Al2O3 |
气体(NO2、NO),溶液中残留4.4g固体.写出上述反应的总的化学方程式5Fe+14HNO3$\frac{\underline{\;\;△\;\;}}{\;}$5Fe(NO3)2+NO2↑+3NO↑+7H2O.
(4)Fe(s)+O2(g)=FeO(s)△H=-272.0kJ/mol
Al(s)+O2(g)=Al2O3(s)△H=-1675.7kJ/mol
Al的单质和FeO反应的热化学方程式是2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1.
19.下列有关乙醇和苯酚的说法中不正确的是( )
| A. | 乙醇和苯酚均无毒,但都能用于消毒、杀菌 | |
| B. | 乙醇和苯酚均能和金属Na反应置换出氢气 | |
| C. | 苯酚能与甲醛反应制造酚醛树脂 | |
| D. | 乙醇的沸点比乙烷高是因为乙醇分子间可以形成氢键 |
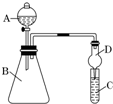 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
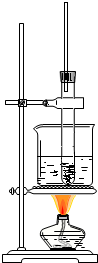 硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下:
硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下: