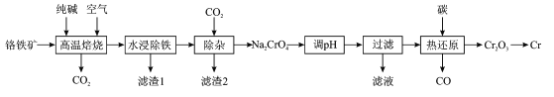
题目内容
【题目】在一定温度下,一定体积的的密闭容器中有如下平衡:H2(g)+I2(g)![]() 2HI(g)。已知H2和I2的起始浓度均为0.10mol·L-1,达到平衡时HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是( )
2HI(g)。已知H2和I2的起始浓度均为0.10mol·L-1,达到平衡时HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是( )
A.0.16B.0.08C.0.04D.0.02
【答案】C
【解析】
由信息可知,
H2(g)+I2(g)![]() 2HI(g)
2HI(g)
开始(mol·L-1)0.1 0.1 0
转化(mol·L-1)0.08 0.08 0.16
平衡(mol·L-1)0.020.02 0.16
则K=![]() =64,
=64,
温度不变,则K不变,可知
H2(g)+I2(g)![]() 2HI(g)
2HI(g)
开始(mol·L-1)0.20.2 0
转化(mol·L-1) xx 2x
平衡(mol·L-1)0.2x0.2x2x
温度不变,则K值不变,即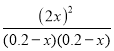 =64,
=64,
解得x=0.16 mol·L-1,
则平衡时H2的浓度是0.2 mol·L-10.16 mol·L-1=0.04 mol·L-1,C项正确,
答案选C。

练习册系列答案
相关题目