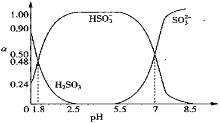
题目内容
【题目】一种柔性水系锌电池为可充电电池,以锌盐溶液作为电解液,其原理如图所示。下列说法正确的是( )
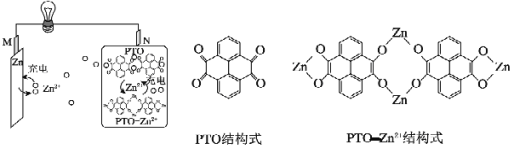
A.充电时,Zn2+向N极移动
B.充电时,N极的电极反应式为PTO—Zn2+-8e-= 2PTO + 4Zn2+
C.若维持电流强度为0.5A,放电10分钟,理论上消耗Zn的质量约为0.20g(已知F=96500C·mol-1)
D.放电时,每生成1mol PTO—Zn2+,M极溶解Zn的质量为65g
【答案】B
【解析】
柔性水系锌可充电电池工作原理为:放电时,金属Zn发生失电子的氧化反应生成Zn2+,即M电极为负极,则N电极为正极,电极反应式为2PTO+8e+4Zn2+═PTOZn2+;充电时,外加电源的正极连接原电池的正极N,外加电源的负极连接原电池的负极,阴阳极的电极反应与原电池的负正极的反应式相反,电解质中阳离子移向阴极、阴离子移向阳极,据此分析解答。
A.充电时,原电池的负极M连接外加电源的负极、作阴极,电解质中阳离子Zn2+移向阴极M,故A错误;
B.充电时,原电池的正极N连接外加电源的正极、作阳极,发生失电子的氧化反应,电极反应式为PTOZn2+8e=2PTO+4Zn2+,故B正确;
C.![]() ,
,![]() ,
,![]() ,
, ,理论上消耗Zn的质量约为
,理论上消耗Zn的质量约为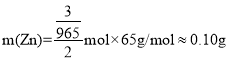 ,故C错误;
,故C错误;
D.放电时,正极反应式为2PTO+8e+4Zn2+═PTOZn2+,负极反应式为Zn2e=Zn2+,电子守恒有4Zn~PTOZn2+,所以每生成1molPTOZn2+,M极溶解Zn的质量=65g/mol×4mol=260g,故D错误;
故选:B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目