题目内容
【题目】将2.5g NaOH、NaHCO3、Na2CO3固体粉末溶于水,制成溶液,然后逐渐向其中滴加1mol/L的盐酸,所加入盐酸的体积与产生的CO2的体积(标准状况)的关系如图像所示:
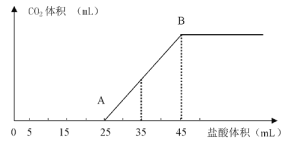
(1)写出OA段发生的离子反应方程式___________________、___________________________
(2)当加入35mL盐酸时,产生CO2的体积为_________________(标准状况)
(3)原混合物中NaOH的质量为_______________
【答案】H++ OH-= H2O CO32+ H+= HCO3 - 224mL 0.6g
【解析】
(1)OA段是氢氧化钠和盐酸反应,再是碳酸钠和盐酸反应生成碳酸氢钠;
(2)25mL—45mL阶段是碳酸氢根和氢离子反应,当加入35mL盐酸时,此时有10mL盐酸用于生成二氧化碳气体,再根据方程式进行计算;
(3)设NaOH、NaHCO3、Na2CO3物质的量分别为x、y,z,建立方程式计算。
(1)OA段是氢氧化钠和盐酸反应,再是碳酸钠和盐酸反应生成碳酸氢钠,因此发生的离子反应方程式H++ OH- = H2O、CO32-+ H+ = HCO3-,故答案为:H++ OH- = H2O、CO32-+ H+= HCO3-;
(2)25mL—45mL阶段是碳酸氢根和氢离子反应,当加入35mL盐酸时,此时有10mL盐酸用于生成二氧化碳气体,且消耗盐酸与产生CO2的比例是1:1,即体积为1 mol/L × 0.01 L × 22.4 L/mol = 0.224L=224mL,故答案为:224mL;
(3)设NaOH、NaHCO3、Na2CO3物质的量分别为x、y,z,建立方程组为:y + z = 0.02 mol,x + z = 0.025mol,40x + 84y + 106z = 2.6g,解得x = 0.015 mol,y = 0.01 mol,z = 0.01 mol,因此粉末原混合物中NaOH的质量为0.015mol×40g/mol = 0.6g,故答案为:0.6g。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。