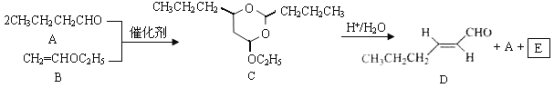
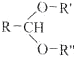
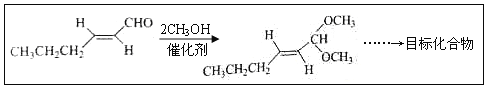
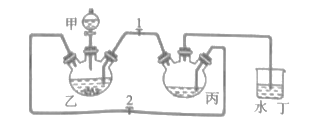
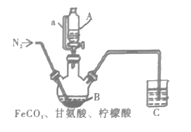
题目内容
【题目】已知反应2FeCl2+Cl2=2FeCl3。现有铁粉、氯气、氧化铁和盐酸四种物质,试用三种方法制取FeCl3(用化学方程式表示)。
(1)___________________。
(2)__________________。
(3)_______________。
【答案】2Fe+3Cl2![]() 2FeCl3 Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑,2FeCl2+Cl2=2FeCl3
2FeCl3 Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑,2FeCl2+Cl2=2FeCl3
【解析】
用三种方法制取FeCl3,可以用铁与氯气反应,也可以用Fe与HCl反应生成FeCl2,再通入氯气得到FeCl3,还可以用氧化铁与盐酸反应生成FeCl3;
已知反应2FeCl2+Cl2=2FeCl3.现有铁粉、氯气、氧化铁和盐酸四种物质,
(1).方案1;铁在氯气中然后生成FeCl3其反应的方程式为:. 2Fe+3Cl2![]() 2FeCl3,
2FeCl3,
故答案为:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(2).方案2;Fe与HCl反应生成FeCl2,再通入氯气得到FeCl3,则反应的方程式为:Fe+2HCl=FeCl2+H2↑,2FeCl2+Cl2=2FeCl3,
故答案为:Fe+2HCl=FeCl2+H2↑,2FeCl2+Cl2=2FeCl3;
(3).方案3;氧化铁与盐酸反应生成FeCl3,则反应的方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
故答案为:Fe2O3+6HCl=2FeCl3+3H2O。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
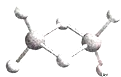
海淀课时新作业金榜卷系列答案【题目】芳香烃在工业生产中有着重要的用途。下列有关苯乙烯和2-苯基丙烯(![]() )的说法错误的是( )
)的说法错误的是( )
A.二者互为同系物
B.均能使澳水溶液褪色
C.分子中的所有原子均可能在同平面上
D.均能发生取代反应和加成反应
【题目】已知以下信息:①1 mol N2的共价键断裂吸收946 kJ的能量;1 mol H2的共价键断裂吸收436 kJ的能量;形成1 mol NH3中的化学键释放1 173 kJ的能量。②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
N2(mol·L-1) | H2(mol·L-1) | NH3(mol·L-1) | |
起始时 | 3 | 3 | 0 |
2s末 | 2.6 | 1.8 | 0.8 |
根据以上相关数据回答问题:
(1)用H2表示该反应2 s内的平均反应速率为________
(2)______(填“能”或“不能”)确认该反应2 s末已达化学平衡状态。
(3)写出该反应的化学方程式:
________________________________________________________________________。
(4)氮气和氢气生成氨气的过程______(填“释放”或“吸收”)能量。