题目内容
【题目】某化学实验室需要0.2mol/LNaOH溶液500mL和0.5mol/L硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
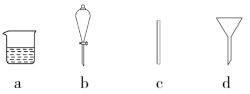
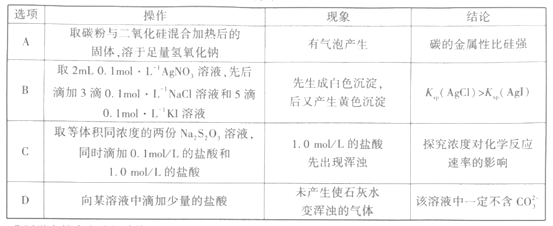
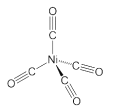
(1)如图所示的仪器中配制溶液肯定不需要的是_______(填序号),配制上述溶液还需用到的玻璃仪器是________________________________(填仪器名称)。

(2)现用质量分数为98%、密度为1.84gcm-3的浓硫酸来配制450mL、0.5molL-1的稀硫酸。计算所需浓硫酸的体积为______mL(保留1位小数),现有①10mL ②25mL③50mL ④100mL四种规格的量筒,你选用的量筒是_____(填代号).
(3)配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序
为:②→①→③→___→___→___→___→④(填序号)
(4)在配制过程中,其他操作都准确,下列操作中错误的是_______,能引起误差偏高的有___________(填代号)。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
【答案】AD 玻璃棒、胶头滴管 13.6 ② ⑧ ⑤ ⑥ ⑦ ①②③④⑥⑦ ①②⑦
【解析】
(1)A为平底烧瓶、D为分液漏斗,在配制溶液过程中不会使用到烧瓶和分液漏斗;配制一定浓度的溶液还缺少玻璃棒和胶头滴管。
故答案为 AD 玻璃棒、胶头滴管
(2)质量分数为98%、密度为1.84g/cm3的浓硫酸的浓度=18.4mol/L;实验室没有450mL的容量瓶,实际上配制的是500mL 0.5mol/L的硫酸,需要浓硫酸的体积为0.5×0.5÷18.4L≈0.0136L=13.6mL,故选择25ml的量筒最合适。
故答案为 13.6 ②
(3)配制一定物质的量浓度的溶液的步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的操作顺序为 ⑧ ⑤ ⑥ ⑦
故答案为⑧ ⑤ ⑥ ⑦
(4)①用量筒量取浓硫酸时,洗涤量筒会导致浓硫酸体积偏大,配制的溶液浓度偏高,故①错误。
②浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容,热的溶液体积偏大,冷却后体积变小,配制的溶液体积偏小,溶液浓度偏高,故②错误。
③稀释浓硫酸应该将酸加入水中,故③错误。
④定容时,加蒸馏水超过标线,应当重新配置,又用胶头滴管吸出会造成溶质损失,配制的溶液浓度偏小,故④错误。
⑤容量瓶未干燥即用来配制溶液,对溶质的物质的量及溶液的体积都没有影响,所以不影响配制结果,故⑤正确。
⑥定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,配制的溶液体积偏大,溶液的浓度偏低,故⑥错误。
⑦在容量瓶中定容时俯视容量瓶刻度线,导致加入的蒸馏水体积低于容量瓶刻度线,配制时加水的体积偏小,溶液的浓度偏高,故⑦错误。
故答案为 ①②③④⑥⑦ ①②⑦