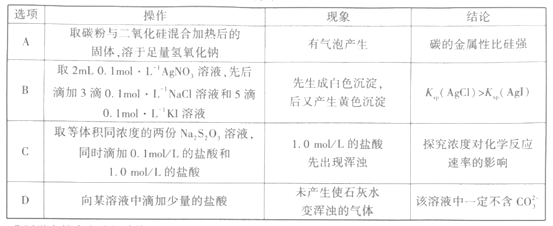
题目内容
【题目】将质量相等的铁片和铜片用导线相连浸入500 mL硫酸铜溶液中构成如图1的装置:
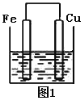
(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为______________,
(2)铜片周围溶液会出现___________的现象。
(3)若2 min后测得铁片和铜片之间的质量差为1.2 g,计算:导线中流过的电子的物质的量为__________mol;
(4)金属的电化学腐蚀的本质是形成了原电池。如下图所示,烧杯中都盛有稀硫酸。
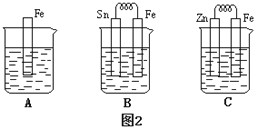
①图2 B中的Sn为________极,Sn极附近溶液的pH(填“增大”“减小”或“不变”)____。
②图2 C中被腐蚀的金属是___________。比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是______。
(5)人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
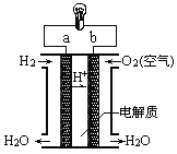
①氢氧燃料电池的正极电极反应是:___________________。电池工作一段时间后硫酸溶液的浓度_____________(填“增大”“减小”或“不变”)。
【答案】![]() 溶液颜色变浅 0.02 正 增大 锌
溶液颜色变浅 0.02 正 增大 锌 ![]()
![]() 减小
减小
【解析】
(1)铁比铜活泼,为原电池的负极,发生氧化反应,电极方程式为![]() ,铜为正极,发生还原反应,电极方程式为
,铜为正极,发生还原反应,电极方程式为![]() ,则铜片周围溶液会出现溶液颜色变浅的现象;
,则铜片周围溶液会出现溶液颜色变浅的现象;
(2)设转移xmol电子,则消耗![]() ,析出
,析出![]() ,则有
,则有![]() ,
,![]() ;
;
(3)①B装置构成原电池,Fe更活泼易失电子作负极,Sn作正极,正极上氢离子得电子发生还原反应而生成氢气,电极反应式为![]() ↑,导致氢离子浓度降低,溶液的pH增大
↑,导致氢离子浓度降低,溶液的pH增大
②A装置中Fe发生化学腐蚀;装置B、C构成原电池,B装置中Fe更活泼易失电子作负极,Sn作正极;C装置中Zn易失电子作负极,Fe作正极,作负极的金属加速被腐蚀,所以锌被腐蚀,作正极的金属铁被保护,金属腐蚀快慢速率为:作负极的金属>发生化学腐蚀的金属>作正极的金属,所以铁被腐蚀快慢速率为![]() ;
;
(4)①氢氧燃料电池的总反应即是氢气与氧气反应生成水,其反应的总方程式为:![]() ;
;
②已知氢氧燃料电池的总反应为:![]() ,电池工作一段时间后,生成水使溶液体积增大,则硫酸的浓度减小。
,电池工作一段时间后,生成水使溶液体积增大,则硫酸的浓度减小。

 名校课堂系列答案
名校课堂系列答案【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大
【题目】对比类推法是一种常用的学习和研究方法。下列离子方程式的书写正确且类推合理的是
选项 | 离子方程式 | 类推 |
A | 家庭漂白原理:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
B | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | 向FeI2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
C | 用石墨电极电解NaCl饱和溶液:2H2O+2Cl- | 用石墨电极电解AlCl3饱和溶液:2H2O+2Cl- |
D | 明矾净水:Al3++3H2O | 硫酸铁净水:Fe3++3H2O |
A.AB.BC.CD.D