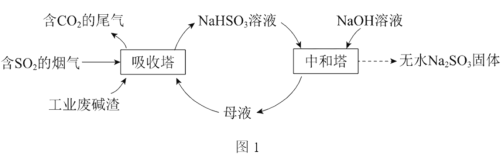
题目内容
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
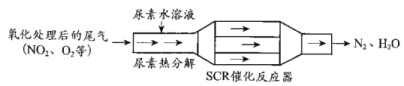
①尿素水溶液热分解为NH3和CO2,该反应的化学方程式:___。
②反应器中NH3还原NO2的化学方程式:___。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:__。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g·mol-1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是__。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
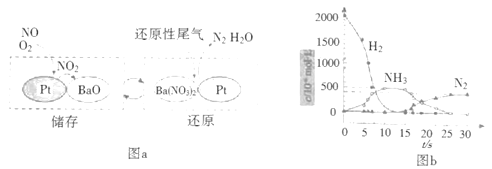
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是__。
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:___![]() □15NNO+□H2O___。
□15NNO+□H2O___。
【答案】CO(NH2)2+H2O![]() CO2+2NH3 8NH3+6NO2
CO2+2NH3 8NH3+6NO2![]() 7N2+12H2O 2SO2+O2+4NH3+2H2O=2(NH4)2SO4
7N2+12H2O 2SO2+O2+4NH3+2H2O=2(NH4)2SO4 ![]() BaO 8∶1 415NO+4NH3+3O2
BaO 8∶1 415NO+4NH3+3O2![]() 415NNO+6H2O
415NNO+6H2O
【解析】
结合反应物、生成物,根据原子守恒,若是氧化还原反应的方程式,再结合得失电子守恒配平化学反应方程式;测定溶液中尿素含量时,将所含氮完全转化为NH3,用过量的稀硫酸吸收氨气,反应后剩余的硫酸,用氢氧化钠溶液中和,整个过程中的,硫酸与氨气、氢氧化钠反应的化学方程式为2NH3+H2SO4=2(NH4)2SO4,2NaOH+H2SO4=2Na2SO4+2H2O。
(1)①尿素水溶液热分解为氨气和二氧化碳,反应方程式为CO(NH2)2+H2O![]() CO2+2NH3 ;
CO2+2NH3 ;
②NH3在催化剂作用下还原NO2生成N2和H2O,反应的化学方程式为8NH3+6NO2![]() 7N2+12H2O;
7N2+12H2O;
③二氧化硫在氧气作用下与氨气和水反应生成硫酸铵,此反应中二氧化硫是还原剂,氧气是氧化剂;反应的化学方程式为2SO2+O2+4NH3+2H2O=2(NH4)2SO4;
④NH3用过量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,过程中所涉及的化学方程式为:2NH3+H2SO4=2(NH4)2SO4,2NaOH+H2SO4=2Na2SO4+2H2O,反应中n(H2SO4)=c1×v1×10-3mol,n(NaOH)=c2×v2×10-3mol,由方程式可知:n(NaOH)+n(NH3)=2n(H2SO4),则n(NH3)=(2c1×v1×10-3-c2×v2×10-3)mol,n[CO(NH2)2]=![]() n(NH3)=
n(NH3)=![]() ×(2c1×v1×10-3-c2×v2×10-3)mol,m[CO(NH2)2]=60g·mol-1×
×(2c1×v1×10-3-c2×v2×10-3)mol,m[CO(NH2)2]=60g·mol-1×![]() ×(2c1×v1×10-3-c2×v2×10-3)mol=(0.06c1×v1-0.03c2×v2)g,所以尿素的质量分数是:
×(2c1×v1×10-3-c2×v2×10-3)mol=(0.06c1×v1-0.03c2×v2)g,所以尿素的质量分数是: ![]() =
=![]() ;
;
(2)①由图可知BaO和NOx反应生成Ba(NO3)2,Ba(NO3)2再被还原为
②第一步反应中H2被氧化生成水,氢元素化合价由0价升高到+1价,Ba(NO3)2中的N元素的化合价由+5价降到-3价,生成氨气,则1molBa(NO3)2生成氨气得到16mol电子,根据氧化还原反应中得失电子守恒,则参加反应的氢气的物质的量为![]() mol=8mol,故第一步反应消耗的H2与Ba(NO3)2的物质的量之比是8:1;
mol=8mol,故第一步反应消耗的H2与Ba(NO3)2的物质的量之比是8:1;
③在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO,由N元素守恒可知,15NO与NH3的物质的量之比应为1:1,结合氧化还原反应中得失电子守恒、原子守恒,可知该反应的化学方程式为:415NO+4NH3+3O2![]() 415NNO+6H2O。
415NNO+6H2O。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案