题目内容
【题目】下列关于价电子构型3s23p4的描述正确的是( )
A. 它的元素符号为O
B. 它的核外电子排布式为1s22s22p63s23p4
C. 常温下,可以与H2化合生成液态化合物
D. 其电子排布图为![]()
【答案】B
【解析】
价电子构型3s23p4的元素为S,结合硫原子的结构和性质分析判断。
A.价电子构型为3s23p4的元素是16号元素S,氧元素的价电子构型为:2s22p4,故A错误;
B.S是16号元素,原子核外有16个电子,根据构造原理知,S原子核外电子排布式为:1s22s22p63s23p4,故B正确;
C.硫和氢气化合生成的硫化氢为气体,且常温下不能化合,故C错误;
D.S原子核外电子排布遵循能量最低原理、保利不相容原理、洪特规则,其正确的轨道表示式为:![]() ,故D错误;
,故D错误;
答案选B。

 53随堂测系列答案
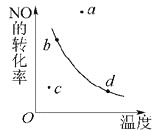
53随堂测系列答案【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入物质,发生反应:PCl3(g)+Cl2(g)![]() PCl5(g) ΔH<0,测得反应的相关数据如下:
PCl5(g) ΔH<0,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
温度/℃ | 200 | 300 | 200 |
起始物质投入量 | 1molPCl3、2molCl2 | 2molPCl3、1molCl2 | 2molCl2、2molPCl5 |
平衡c(PCl5)/mol·L-1 | c1 | c2 | c3 |
化学平衡常数 | K1 | K2 | K3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的转化率α | α1(PCl3) | α2(Cl2) | α3(PCl5) |
下列说法正确的是( )
A.K1<K2
B.c1<c2
C.p3=2p1
D.α1(PCl3)+α3(PCl5)<1
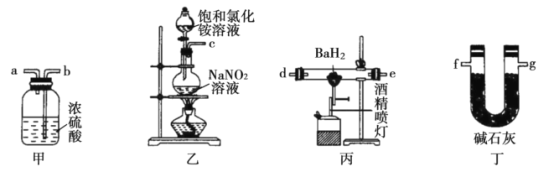
【题目】苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
熔点/℃ | 122.4 | ﹣97 | ﹣12.3 |
沸点/℃ | 249 | 64.3 | 199.6 |
密度/g.cm﹣3 | 1.2659 | 0.792 | 1.0888 |
水溶性 | 微溶 | 互溶 | 不溶 |
实验一:制取苯甲酸甲酯
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。

(1)苯甲酸与甲醇反应的化学方程式为______________________________________。
(2)中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有___________________________
实验二:提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(3)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是__________________。
(4)用图C装置进行蒸馏提纯时,当温度计显示____________时,可用锥形瓶收集苯甲酸甲酯。
(5)最终制取15g苯甲酸甲酯,计算得苯甲酸甲酯的产率为______________(小数点后保留1位有效数字)。