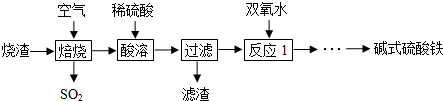
题目内容
6. 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验.
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验.请回答:
(1)A中发生的化学反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是NaOH溶液,
(3)装置B的作用是贮存多余的气体.B中应放置的液体是d(填字母)
a.水 b.酸性KMnO4溶液c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18mol•L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①有一定量的余酸但未能使铜片完全溶解,你认为原因是随反应进行,硫酸浓度变稀,Cu不与稀H2SO4反应
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是ad(填字母).
a.铁粉 b.BaCl2溶液 c.银粉 d.NaHCO3溶液.
分析 (1)浓硫酸具有强氧化性,在加热时可以氧化单质铜,生成硫酸铜、二氧化硫和水;
(2)二氧化硫是污染性气体,不能排放到大气中,可以用氢氧化钠溶液吸收;
(3)所选试剂不能和二氧化硫气体反应,也不能溶于液体,据此进行判断;
(4)①从浓硫酸随着反应进行浓度变稀,铜不和稀硫酸发生反应分析;
②证明酸剩余的关键是证明反应后的溶液中存在氢离子,据此对各选项进行判断.
解答 解:(1)浓硫酸具有强氧化性,在加热时可以氧化单质铜生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫气体排放到大气中污染环境,所以装置D中试管口放置的棉花中应浸一种液体能与二氧化硫反应,可以浸氢氧化钠溶液或碳酸钠溶液等碱性溶液,作用是吸收多余的二氧化硫气体,防止污染空气,
故答案为:NaOH溶液;
(3)二氧化硫气体是酸性氧化物,易溶于水,B中的试剂不能和二氧化硫发生反应,不能溶解二氧化硫,
a.水能溶解二氧化硫不能储存气体,故a错误;
b.酸性KMnO4 溶液能氧化二氧化硫为硫酸,不能储存气体,故b错误;
c.浓溴水吸收二氧化硫,不能储存气体,故c错误;
d.二氧化硫通入饱和NaHSO3溶液中,降低了二氧化硫的溶解度,不反应,可以用来储存气体,故d正确;
故答案为:d;
(4)①一定质量的铜片和一定体积18mol•L-1的浓硫酸放在圆底烧瓶中共热,浓硫酸随着反应进行,浓度变小成为稀硫酸,稀硫酸不再和铜发生反应,所以有一定量的余酸但未能使用铜片完全溶解,
故答案为:随反应进行,硫酸浓度变稀,Cu不与稀H2SO4反应;
②能用来证明反应结束后的烧瓶中确有余酸,实质是证明氢离子的存在,
a.铁粉与稀硫酸反应放气体,可以证明,故a正确;
b.BaCl2溶液加入后出现白色沉淀,但因为生成产物中有硫酸铜生成,也可以生成白色沉淀,故不能证明,故b错误;
c.银粉不与稀硫酸反应不能证明,故c错误;
d.Na2CO3溶液会与稀硫酸反应发出二氧化碳气体,可以证明,故d正确;
故答案为:ad.
点评 本题考查了浓硫酸的性质及其应用,题目难度中等,涉及浓硫酸的性质、反应产物的性质及验证等知识,熟练掌握浓硫酸的性质、二氧化硫的性质及检验方法为解答关键,试题培养了学生的分析能力及化学实验能力.

| A. | 四种元素中有两种元素在第二周期 | |
| B. | W所在主族元素T可能形成T2O、T2O2、TO2型化合物 | |
| C. | X、Y、Z的最高价氧化物对应的水化物两两之间能反应 | |
| D. | Y单质可与盐酸反应,而不能与氢氧化钠溶液反应 |
| A. | NaOH | B. | Na2O2 | C. | KCl | D. | HF |
| A. | 氮分子的电子式 N:::N | B. | 镁原子的原子结构示意图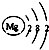 | ||
| C. | 质量数是16的氧原子 ${\;}_{8}^{16}O$ | D. | 乙醇的结构简式 C2H5OH |

已知:25℃时,Ksp[Fe(OH)3]=2.79×10-39
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3、Al(OH)3.
③已知:Fe(OH)3(s)?Fe3+ (aq)+3OH-(aq)△H=akJ/mol
 H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol
H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol请写出Fe3+发生水解反应的热化学方程式:Fe3+(aq)+3H2O(l)?Fe(OH)3(s)+3H+ (aq)△H=(3b-a)kJ/mol.水解平衡常数Kh=$\frac{1{0}^{-3}}{2.79}$.
④加盐酸调整pH为2~3的目的为抑制CoCl2水解.
⑤操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
(2)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料C6中(如图所示).电池反应为LiCoO2+C6$?_{放电}^{充电}$CoO2+LiC6,写出该电池放电时的正极反应式:CoO2+Li++e-=LiCoO2.
| A. | CH4分子的比例模型: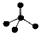 | B. | 氯原子的结构示意图: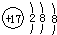 | ||
| C. | 乙烯的结构简式 CH2CH2 | D. | CS2结构式:S=C=S |
| A. | 乙烯可发生加成反应,而乙烷不能 | |
| B. | 甲苯可以使高锰酸钾溶液褪色,而乙烷不能 | |
| C. | 甲苯与硝酸作用可得到2,4,6-三硝基甲苯,而苯与硝酸作用得到硝基苯 | |
| D. | 苯酚能与NaOH溶液反应,而乙醇不能 |