题目内容
19.乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去).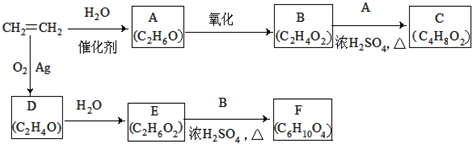
请回答下列问题:
(1)A的化学名称是乙醇.
(2)生成A的化学方程式为CH2=CH2+H2O $\stackrel{催化剂}{→}$CH3CH2OH,该反应的类型为加成反应.
(3)D为环状化合物,其结构简式为
 .
.(4)F的结构简式为
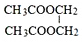 .
.
分析 乙烯与水加成生成A,A为乙醇,乙醇催化氧化生成B,B为乙酸,乙酸与乙醇反应生成C,C为乙酸乙酯,乙烯与氧气反应生成D(C2H4O),D为环状化合物,所以D为环氧乙烷 ,根据E和F的分子式及B的结构可知,E与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯
,根据E和F的分子式及B的结构可知,E与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯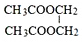 ,据此解答.
,据此解答.
解答 解:乙烯与水加成生成A,A为乙醇,乙醇催化氧化生成B,B为乙酸,乙酸与乙醇反应生成C,C为乙酸乙酯,乙烯与氧气反应生成D(C2H4O),D为环状化合物,所以D为环氧乙烷 ,根据E和F的分子式及B的结构可知,E与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯
,根据E和F的分子式及B的结构可知,E与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯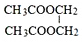 ,
,
(1)由上述分析可知,A是乙醇,
故答案为:乙醇;
(2)生成A的化学方程式为CH2=CH2+H2O $\stackrel{催化剂}{→}$CH3CH2OH,该反应的类型为加成反应,
故答案为:CH2=CH2+H2O $\stackrel{催化剂}{→}$CH3CH2OH;加成反应;
(3)由上述分析可知,D为环氧乙烷 ,
,
故答案为: ;
;
(4)由上述分析可知,F为二乙酸乙二酯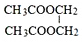 ,
,
故答案为: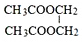 .
.
点评 本题考查有机推断,涉及烯烃、醇、醛、羧酸等性质以及学生推理能力等,是对有机化合物知识的综合考查,能较好的考查考生的思维能力,根据乙烯与D的分子式,结合E与乙酸反应生成F,各分子中C原子数目,判断D的结构是解题的关键,难度中等,是高考热点题型.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
9.下列物质中不属于醇类的是( )
| A. | C3H7OH | B. | 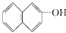 | C. | CH2OHCHOHCH2OH | D. | 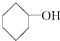 |
7.硅橡胶 是由
是由 经两种反应而制得的,这两种反应依次是( )
经两种反应而制得的,这两种反应依次是( )
 是由
是由 经两种反应而制得的,这两种反应依次是( )
经两种反应而制得的,这两种反应依次是( )| A. | 消去、加聚 | B. | 水解、缩聚 | C. | 氧化、缩聚 | D. | 取代、加聚 |
14.W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:四种元素的电子层数之和为10,且它们分别属于连续的四个主族;四种元素的原子中半径最大的是X原子.下列说法正确的( )
| A. | 四种元素中有两种元素在第二周期 | |
| B. | W所在主族元素T可能形成T2O、T2O2、TO2型化合物 | |
| C. | X、Y、Z的最高价氧化物对应的水化物两两之间能反应 | |
| D. | Y单质可与盐酸反应,而不能与氢氧化钠溶液反应 |
4.下列有关物质的性质或应用的说法正确的是( )
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| C. | 酸性高锰酸钾溶液和溴水都既能鉴别出甲烷和乙烯又能除去甲烷中含有的乙烯再经干燥而获得纯净的甲烷 | |
| D. | 辛烷、己烯和苯在工业上都可直接通过石油分馏得到 |
8. 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )| A. | $\frac{8M}{{N}_{A}•{a}^{3}}$g.cm-3 | B. | $\frac{M{a}^{3}}{8{N}_{A}}$gcm-3 | C. | $\frac{M}{{N}_{A}•{a}^{3}}$g.cm-3 | D. | $\frac{Ma}{{N}_{A}}$g.cm |
11.(1)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如下:

已知:25℃时,Ksp[Fe(OH)3]=2.79×10-39
①净化除杂时,加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3、Al(OH)3.
③已知:Fe(OH)3(s)?Fe3+ (aq)+3OH-(aq)△H=akJ/mol H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol
H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol
请写出Fe3+发生水解反应的热化学方程式:Fe3+(aq)+3H2O(l)?Fe(OH)3(s)+3H+ (aq)△H=(3b-a)kJ/mol.水解平衡常数Kh=$\frac{1{0}^{-3}}{2.79}$.
④加盐酸调整pH为2~3的目的为抑制CoCl2水解.
⑤操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
(2)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料C6中(如图所示).电池反应为LiCoO2+C6$?_{放电}^{充电}$CoO2+LiC6,写出该电池放电时的正极反应式:CoO2+Li++e-=LiCoO2.

已知:25℃时,Ksp[Fe(OH)3]=2.79×10-39
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3、Al(OH)3.
③已知:Fe(OH)3(s)?Fe3+ (aq)+3OH-(aq)△H=akJ/mol
 H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol
H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol请写出Fe3+发生水解反应的热化学方程式:Fe3+(aq)+3H2O(l)?Fe(OH)3(s)+3H+ (aq)△H=(3b-a)kJ/mol.水解平衡常数Kh=$\frac{1{0}^{-3}}{2.79}$.
④加盐酸调整pH为2~3的目的为抑制CoCl2水解.
⑤操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
(2)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料C6中(如图所示).电池反应为LiCoO2+C6$?_{放电}^{充电}$CoO2+LiC6,写出该电池放电时的正极反应式:CoO2+Li++e-=LiCoO2.
