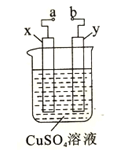
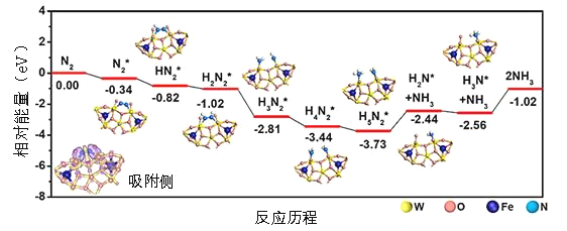
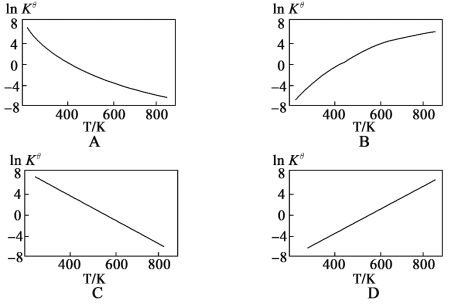
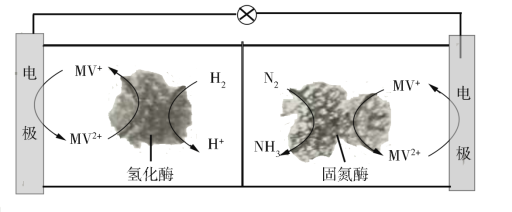
题目内容
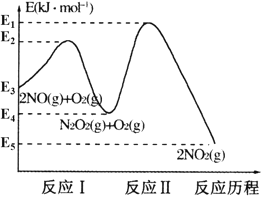
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H,上述反应分两步完成,其反应历程如图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如图所示:
回答下列问题:
(1)写出反应I的热化学方程式___。
(2)反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是___(反应未使用催化剂)。
2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是___(反应未使用催化剂)。
【答案】2NO(g)N2O2(g) △H=-(E3-E4) kJ/ mol 反应Ⅱ 决定总反应速率的是反应Ⅱ,升高温度后反应I平衡逆向移动,造成N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,N2O2浓度减小导致反应Ⅱ速率变慢
【解析】
(1)根据图像分析反应I为2NO(g)N2O2(g)的焓变,写出热化学方程式;
(2)根据图像可知,反应I的活化能<反应Ⅱ的活化能,反应I为快反应,反应Ⅱ为慢反应,决定该反应速率的是慢反应;决定正反应速率的是反应Ⅱ,结合升高温度对反应I和Ⅱ的影响分析可能的原因。
(1)根据图像可知,反应I的化学方程式为:2NO(g)N2O2(g) △H=(E4-E3)kJ/mol=-(E3-E4) kJ/ mol,故答案为:2NO(g)N2O2(g) △H=-(E3-E4) kJ/ mol;
(2)根据图像可知,反应I的活化能<反应Ⅱ的活化能,反应I为快反应,反应Ⅱ为慢反应,决定2NO(g)+O2(g)2NO2(g)反应速率的是慢反应Ⅱ;对该反应体系升高温度,发现总反应速率变慢,可能的原因是:决定总反应速率的是反应Ⅱ,升高温度后反应I平衡逆向移动,造成N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,N2O2浓度减小导致反应Ⅱ速率变慢,故答案为:反应Ⅱ;决定总反应速率的是反应Ⅱ,升高温度后反应I平衡逆向移动,造成N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,N2O2浓度减小导致反应Ⅱ速率变慢。

【题目】I.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7.2H2O),其主要工艺流程如下图:
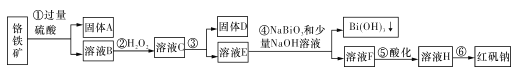
查阅资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的 pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)固体A的主要成分为____(填化学式)。
(2)步骤③加的试剂为氢氧化钠溶液,此时溶液pH要调到5.0的目的是____。
(3)写出④反应的离子反应方程式:____。
(4)取一定质量的固体D溶解于200 mL的硫酸中,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则加入NaOH溶液体积为200~240 mL时发生反应的化学方程式为____,固体D中含铁化合物的物质的量为____

Ⅱ.经检测该化工厂的工业废水中含5.00×10-3mol/L的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Fe的化合价依次为+3、+2),又设计了如下工艺流程:
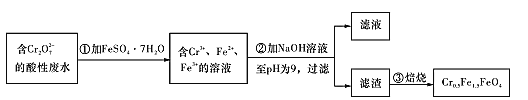
(5)第①步反应的离子方程式为____。
(6)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加FeSO4.7H2O的质量为 ___g(已知FeSO4.7H2O的摩尔质量为278 g/mol)。