题目内容
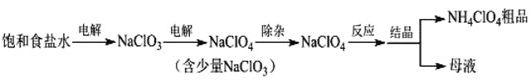
【题目】I.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7.2H2O),其主要工艺流程如下图:
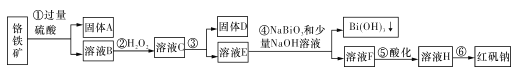
查阅资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的 pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)固体A的主要成分为____(填化学式)。
(2)步骤③加的试剂为氢氧化钠溶液,此时溶液pH要调到5.0的目的是____。
(3)写出④反应的离子反应方程式:____。
(4)取一定质量的固体D溶解于200 mL的硫酸中,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则加入NaOH溶液体积为200~240 mL时发生反应的化学方程式为____,固体D中含铁化合物的物质的量为____

Ⅱ.经检测该化工厂的工业废水中含5.00×10-3mol/L的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Fe的化合价依次为+3、+2),又设计了如下工艺流程:
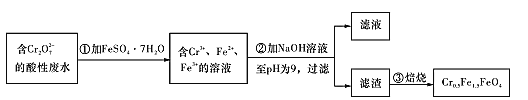
(5)第①步反应的离子方程式为____。
(6)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加FeSO4.7H2O的质量为 ___g(已知FeSO4.7H2O的摩尔质量为278 g/mol)。
【答案】SiO2 使Fe3+、Al3+均完全转化为Fe(OH)3、Al(OH)3沉淀除去,而Cr3+不沉淀 3NaBiO3+2Cr3++7OH- +H2O==2CrO42-+3Na++3Bi(OH)3 NaOH+Al(OH)3==NaAlO2+2H2O 0.1mol Cr2O72-+14H++6Fe2+==2Cr3++6Fe3++7H2O 13.9
【解析】
铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)中加入过量硫酸,FeO、Cr2O3、Al2O3溶解生成Cr2(SO4)3、FeSO4、Al2(SO4)3,从而得到溶液B,沉淀A为SiO2;溶液B中加入H2O2,Fe2+被氧化为Fe3+,得到溶液C;调节pH使Fe3+、Al3+全部转化为沉淀,得到固体D,所得溶液E中主要含有Cr3+;加入NaBiO3和少量NaOH溶液,此时生成的Bi3+转化为Bi(OH)3沉淀,Cr3+被氧化为CrO42-,得到溶液F;将溶液F酸化,CrO42-转化为Cr2O72-,得到溶液H;蒸发结晶得到红矾钠(主要成分Na2Cr2O7.2H2O)。
(1)由以上分析知,固体A的主要成分为SiO2。答案为:SiO2;
(2)步骤③中,需将Al3+、Fe3+除去,于是加入了氢氧化钠溶液,此时溶液pH要调到5.0的目的是使Fe3+、Al3+均完全转化为Fe(OH)3、Al(OH)3沉淀除去,而Cr3+不沉淀。答案为:使Fe3+、Al3+均完全转化为Fe(OH)3、Al(OH)3沉淀除去,而Cr3+不沉淀;
(3)步骤④中,加入NaBiO3和少量NaOH溶液,此时生成的Bi3+转化为Bi(OH)3沉淀,Cr3+被氧化为CrO42-,反应的离子反应方程式:3NaBiO3+2Cr3++7OH- +H2O==2CrO42-+3Na++3Bi(OH)3。答案为:3NaBiO3+2Cr3++7OH- +H2O==2CrO42-+3Na++3Bi(OH)3;
(4)从图中可以看出,NaOH溶液的体积,从200mL增加到240mL,主要是将Al(OH)3转化为AlO2-,发生反应的化学方程式为NaOH+Al(OH)3==NaAlO2+2H2O;则将Al3+转化为Al(OH)3,需要消耗NaOH溶液40mL×3=120mL,则Fe3+转化为Fe(OH)3需消耗NaOH溶液200mL-20mL-120mL=60mL,n[Fe(OH)3]=![]() ×5 mol/L×0.06L=0.1mol。答案为:NaOH+Al(OH)3==NaAlO2+2H2O;0.1mol;
×5 mol/L×0.06L=0.1mol。答案为:NaOH+Al(OH)3==NaAlO2+2H2O;0.1mol;
Ⅱ.(5)第①步操作,Fe2+将Cr2O72-还原为Cr3+,Fe2+转化为Fe3+,发生反应的离子方程式为Cr2O72-+14H++6Fe2+==2Cr3++6Fe3++7H2O。答案为:Cr2O72-+14H++6Fe2+==2Cr3++6Fe3++7H2O;
(6)欲使1 L该废水中的n(Cr2O72-)=5.00×10-3mol/L×1L=5.00×10-3mol,依据质量守恒,完全转化为Cr0.5Fe1.5FeO4的物质的量为0.02mol,理论上需要加FeSO4.7H2O的物质的量为0.02mol×2.5=0.05mol,质量为0.05mol×278 g/mol =13.9g。答案为:13.9。

【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
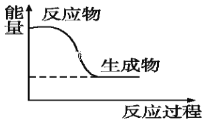
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。