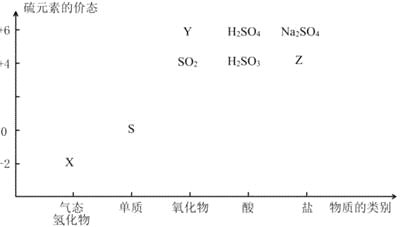
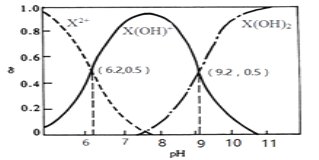
题目内容
【题目】(1)已知: 25℃、101 kPa时,
I.H2(g) + ![]() O2(g) = H2O(g) △H1 =- 241.8kJ/mol
O2(g) = H2O(g) △H1 =- 241.8kJ/mol
II.H2(g) + ![]() O2(g) = H2O(l) △H2 =-2858kJ/mol
O2(g) = H2O(l) △H2 =-2858kJ/mol
试回答下列问题:
①能表示氢气燃烧热的热化学方程式为____ (填“I” 或“II”)
②H2O(g) = H2O(l) △H = ___ kJ/mol。
(2)已知: 25℃、101 kPa时,CO(g) + H2O(g)![]() CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
①放出的热量___41.0kJ(填“>”、“<”或“=”);
②该反应的平衡常数表达式K =__
③其他条件不变时,升高温度,c(H2)将__
A 大 B 小 C 变
(3)常温下,现有0.1mol/L FeCl3溶液:
①该溶液呈___(填“酸性”、 “碱性”或“中性");
②为沉淀Fe3+,加入定量氨水调节pH,当c(Fe3+)= 4.0×10-5mol/L时,溶液的pH=__( 已知Ksp[Fe(OH)3]= 4.0×10-38)。
(4)如图是电解CuSO4溶液的装置示意图。a、b是电源的两极,x、y都是石墨电极。通电一段时间后,y极上有气泡产生。试回答下列问题:①电源的正极是__(填 “a”或“b”);②有关溶液变化的描述正确的是______;
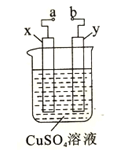
A.pH降低
B.SO42-浓度减小
C.Cu2+浓度增大
③x极的电极反应式为________
【答案】II -44.0 < ![]() B 酸性 3.0 b A Cu2+ + 2e- = Cu
B 酸性 3.0 b A Cu2+ + 2e- = Cu
【解析】
(1)①氢气的燃烧热是1molH2完全燃烧生成液态水放出的能量;②利用盖斯定律计算H2O(g) = H2O(l)的焓变;
(2)①CO(g) + H2O(g)![]() CO2(g) + H2(g)反应可逆;
CO2(g) + H2(g)反应可逆;
②平衡常数是生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
③CO(g) + H2O(g)![]() CO2(g) + H2(g) △H = -41.0 kJ/mol,正反应放热,升高温度平衡逆向移动;
CO2(g) + H2(g) △H = -41.0 kJ/mol,正反应放热,升高温度平衡逆向移动;
(3)①FeCl3是强酸弱碱盐,Fe3+水解;
②根据Ksp[Fe(OH)3]= 4.0×10-38计算当c(Fe3+)= 4.0×10-5mol/L时溶液的pH;
(4)用石墨电极电极硫酸铜溶液的方程式是![]() ;
;
(1)①氢气的燃烧热是1molH2完全燃烧生成液态水放出的能量,能表示氢气燃烧热的热化学方程式为H2(g) + ![]() O2(g) = H2O(l) △H2 =-2858kJ/mol,故选II;
O2(g) = H2O(l) △H2 =-2858kJ/mol,故选II;
②I.H2(g) + ![]() O2(g) = H2O(g) △H1 =- 241.8kJ/mol
O2(g) = H2O(g) △H1 =- 241.8kJ/mol
II.H2(g) + ![]() O2(g) = H2O(l) △H2 =-2858kJ/mol
O2(g) = H2O(l) △H2 =-2858kJ/mol
根据盖斯定律II-I 得 H2O(g)= H2O(l)△H = -2858kJ/mol - (- 241.8kJ/mol)= -44.0kJ/mol;
(2)根据热化学方程式 25℃、101 kPa时,CO(g) + H2O(g)![]() CO2(g) + H2(g) △H = -41.0 kJ/mol,可知1molCO和Imol H2O(g)完全反应放出能量41.0 kJ;由于CO(g) + H2O(g)
CO2(g) + H2(g) △H = -41.0 kJ/mol,可知1molCO和Imol H2O(g)完全反应放出能量41.0 kJ;由于CO(g) + H2O(g)![]() CO2(g) + H2(g)反应可逆,将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡,参加反应的CO小于1mol,所以放出的能量小于41.0 kJ;
CO2(g) + H2(g)反应可逆,将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡,参加反应的CO小于1mol,所以放出的能量小于41.0 kJ;
②CO(g) + H2O(g)![]() CO2(g) + H2(g)的平衡常数表达式K =
CO2(g) + H2(g)的平衡常数表达式K =![]() ;
;
③CO(g) + H2O(g)![]() CO2(g) + H2(g) △H = -41.0 kJ/mol,正反应放热,升高温度平衡逆向移动,c(H2)将减小,选B;
CO2(g) + H2(g) △H = -41.0 kJ/mol,正反应放热,升高温度平衡逆向移动,c(H2)将减小,选B;
(3)①FeCl3是强酸弱碱盐,Fe3+水解,溶液呈酸性;
②c(Fe3+)= 4.0×10-5mol/L时,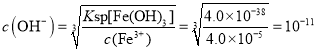 ,所以c(H+)=10-3,pH=3.0;
,所以c(H+)=10-3,pH=3.0;
(4)①电解硫酸铜溶液的总方程式是![]() ,y极上有气泡产生,说明y极放出氧气,y是阳极,则电源的正极是b;
,y极上有气泡产生,说明y极放出氧气,y是阳极,则电源的正极是b;
②A .总反应中有硫酸生成,所以溶液pH降低,故A正确;
B .总反应消耗水,所以SO42-浓度增大,故B错误;
C .Cu2+发生还原反应生成铜单质,所以Cu2+浓度减小,故C错误;
故选A;
③x极是阴极,阴极铜离子得电子生成铜单质,X的电极反应式为Cu2+ + 2e- = Cu。

【题目】氯化亚硝酰(NOC1,沸点为-5.5 °C )是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2 + HNO3 =AgNO3+ HNO2。
(1)将5g在300°C下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002 mol NO2。反应12~36 min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为____________, 氯化钾需要“干燥”的原因是_____________。
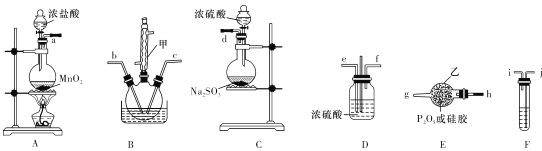
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。
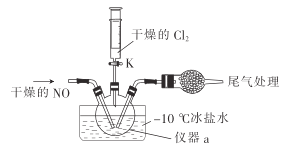
①仪器a的名称为__________。
②干燥管中盛放的试剂为____________。
③生成NOCl的化学方程式为________________。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
步骤 | 实验现象或反应的化学方程式 |
①取5ml三颈烧瓶中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O发应的化学方程式_______ |
②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为___________ |
③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为___________ |