题目内容
【题目】元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
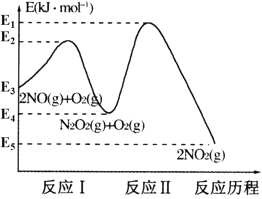
23、三氟化溴(BrF3)常用于核燃料生产和后处理,遇水立即发生如下反应:3BrF3 +5H2O → HBrO3+ Br2+ 9HF+ O2 。该反应中氧化剂与还原剂的物质的量之比为________,每生成2.24 LO2(标准状况)转移电子数为__________。
24、在食盐中添加少量碘酸钾可预防缺碘。为了检验食盐中的碘酸钾,可加入醋酸和淀粉-碘化钾溶液。看到的现象是________________________,相应的离子方程式是_______________________。
氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) ---------------①
Cl2(aq) ---------------①
Cl2(aq)+ H2O![]() HClO + H++Cl------②
HClO + H++Cl------②
HClO![]() H++ ClO----------------③
H++ ClO----------------③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
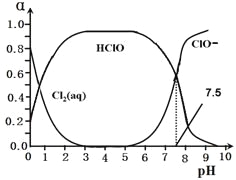
25、写出上述体系中属于电离平衡的平衡常数表达式:Ki =_______,由图可知该常数值为_________。
26、在该体系中c(HClO) + c(ClO-)_______c(H+)-c(OH-)(填“大于”“小于”或“等于”)。
27、用氯处理饮用水时,夏季的杀菌效果比冬季______(填“好”或“差”),请用勒夏特列原理解释________________________________________________________________。
【答案】2:3 0.6NA 溶液变蓝 5I-+ IO3-+6 CH3COOH →3I2+ 3H2O + 6CH3COO- 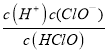 10-7.5或 3.16×10-8 小于 差 温度升高,(溶解)平衡①逆向移动,Cl2(aq)浓度减少,使得(化学平衡)②逆向移动,c(HClO)减少,杀菌效果变差
10-7.5或 3.16×10-8 小于 差 温度升高,(溶解)平衡①逆向移动,Cl2(aq)浓度减少,使得(化学平衡)②逆向移动,c(HClO)减少,杀菌效果变差
【解析】
23.在反应3BrF3 +5H2O =HBrO3+ Br2+ 9HF+ O2中,3个BrF3 分子中,1分子是还原剂,2分子是氧化剂,另外5个水分子中也有2分子是还原剂,故反应中氧化剂与还原剂的物质的量之比为2:3;每生成为0.1molO2时,有0.2mol BrF3被还原转移电子数为0.6NA。
24.检验食盐中的碘酸钾,可加入醋酸和淀粉-碘化钾溶液后可看到溶液变蓝,是由于酸性条件下碘酸根离子被还原,碘离子被氧化生成碘单质的缘故,发生反应的离子方程式为:5I-+ IO3-+6 CH3COOH =3I2+ 3H2O + 6CH3COO-要注意醋酸为弱酸不可拆分。
25.反应③为电离平衡,故电离平衡常数为:K=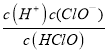 ;图中显示在pH=7.5时达到电离平衡,此时c(ClO-)=c(HClO),K=c(H+)=10-7.5;
;图中显示在pH=7.5时达到电离平衡,此时c(ClO-)=c(HClO),K=c(H+)=10-7.5;
26.在该体系中存在电荷守恒,即:c(OH-)+ c(ClO-) + c(Cl-)==c(H+),可得c(ClO-) + c(Cl-)==c(H+)-c(OH-),溶液中c(Cl-)大于c(HClO),故c(HClO) + c(ClO-)小于c(H+)-c(OH-);
27.用氯处理饮用水时,夏季的杀菌效果比冬季差,原因是依据勒夏特列原理,夏季温度高,溶解平衡逆向移动,Cl2(aq)浓度减少,使得反应②逆向移动,溶液中HClO的浓度减少,漂白效果降低。

【题目】氯化亚硝酰(NOC1,沸点为-5.5 °C )是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2 + HNO3 =AgNO3+ HNO2。
(1)将5g在300°C下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002 mol NO2。反应12~36 min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为____________, 氯化钾需要“干燥”的原因是_____________。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。

①仪器a的名称为__________。
②干燥管中盛放的试剂为____________。
③生成NOCl的化学方程式为________________。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
步骤 | 实验现象或反应的化学方程式 |
①取5ml三颈烧瓶中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O发应的化学方程式_______ |
②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为___________ |
③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为___________ |