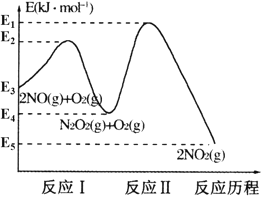
题目内容
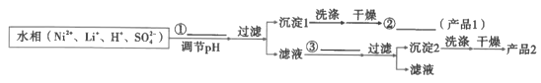
【题目】室温时,用0.1000 mol· L -1的NaOH溶液滴定0. 1000 mol· L -1的顺丁烯二酸H2A的滴定曲线如下图所示(pKa= lgKa),下列说法错误的是
A.用NaOH溶液滴定NaHA溶液可用酚酞作指示剂
B.a点:c(HA-)=c(H2A)
C.H2A的Ka2=10-6
D.d点:c(Na+)<c(HA-)+2c(A2-)
【答案】D
【解析】
A.酚酞的变色范围为8.210.0,第二个滴定终点时溶液的pH=9.5左右,可用酚酞作为NaOH溶液滴定NaHA溶液滴定终点的指示剂,故A正确;
B.a点pH = pKa1,即lgc(H+) = lgKa1,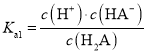 ,
,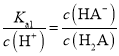 ,因此c(HA-)=c(H2A),故B正确;
,因此c(HA-)=c(H2A),故B正确;
C.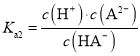 ,c点c(HA-)=c(A2),pH =6,因此H2A的Ka2=106,故C正确;
,c点c(HA-)=c(A2),pH =6,因此H2A的Ka2=106,故C正确;
D.溶液中存在电荷守恒,c(H+) + c(Na+) = c(HA-)+2c(A2) + c(OH-),d点溶液显碱性,因此:c(Na+) > c(HA-)+2c(A2),故D错误。
综上所述,答案为D。

 黎明文化寒假作业系列答案
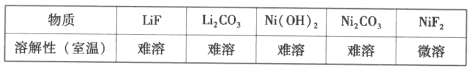
黎明文化寒假作业系列答案【题目】氯化亚硝酰(NOC1,沸点为-5.5 °C )是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2 + HNO3 =AgNO3+ HNO2。
(1)将5g在300°C下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002 mol NO2。反应12~36 min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为____________, 氯化钾需要“干燥”的原因是_____________。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。
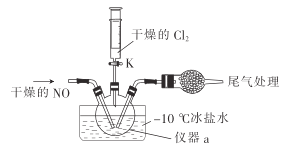
①仪器a的名称为__________。
②干燥管中盛放的试剂为____________。
③生成NOCl的化学方程式为________________。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
步骤 | 实验现象或反应的化学方程式 |
①取5ml三颈烧瓶中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O发应的化学方程式_______ |
②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为___________ |
③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为___________ |