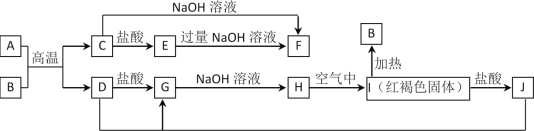
题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是
A.2.5 g NaD与足量水反应生成的氢气中含中子数0. 1NA
B.0.1 mol H2O与0. 1 mol H2O2含H—O键数目均为0. 2NA
C.0.1 mol Na2CO3NaHCO32H2O溶于水形成的1 L溶液中CO32一和HCO3一数目之和为0.2NA
D.电解精炼铜时,阴极增重64 g时,转移的电子数为2NA
【答案】C
【解析】
A.2.5 g NaD物质的量![]() ,与足量水反应NaD + H2O =NaOH + HD↑,0.1molNaD生成0.1mol HD,H不含中子,D含有1个中子,因此0.1mol HD中含中子数0. 1NA,故A正确;
,与足量水反应NaD + H2O =NaOH + HD↑,0.1molNaD生成0.1mol HD,H不含中子,D含有1个中子,因此0.1mol HD中含中子数0. 1NA,故A正确;
B.H2O结构为H—O—H,H2O2结构为H—O—O—H,因此0.1 mol H2O与0. 1 mol H2O2含H—O键数目均为0. 2NA,故B正确;
C.0.1 mol Na2CO3NaHCO32H2O溶于水形成的1 L溶液,根据物料守恒得到溶液中CO32、HCO3一、H2CO3数目之和为0.2NA,故C错误;
D.电解精炼铜时,阴极上Cu2+放电:Cu2++2e = Cu,电路中转移电子数为2NA即2mol时,阴极析出1mol铜,即阴极的质量增加64g,故D正确。
综上所述,答案为C。

 名校课堂系列答案
名校课堂系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
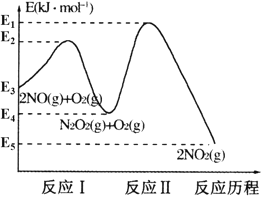
(1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图:
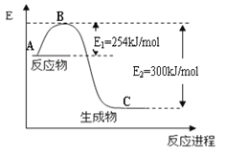
请写出NO2和CO反应的热化学方程式:___。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)+Q(Q>0),其化学平衡常数K与T的关系如下表:
2NH3(g)+Q(Q>0),其化学平衡常数K与T的关系如下表:
T/K | 298 | 398 | 498 | … |
K/ | 4.1×106 | K1 | K2 | … |
请完成下列问题:比较K1、K2的大小:K1___K2(填写“>”、“=”或“<”)
(3)判断该反应达到化学平衡状态的依据的是___(选填字母序号)。
A.2v(H2)正=3v(NH3)逆 B.2v(N2)正=v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
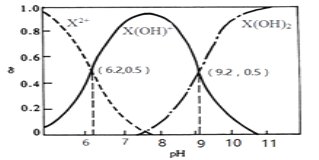
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。盐酸肼第一步水解反应的离子方程式___;
盐酸肼水溶液中离子浓度的排列顺序正确的是___(填序号)。
a.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
b.c(Cl-)>c([N2H5H2O]+)>c(H+)>c(OH-)
c.2c(N2H62+)+c([N2H5H2O]+)+c(H+)=c(Cl-)+c(OH-)
d.2c(N2H62+)+2c([N2H5H2O]+)+2c([N2H42H2O]=c(Cl-)
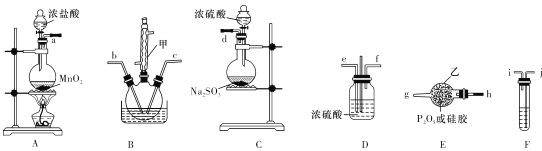
【题目】氯化亚硝酰(NOC1,沸点为-5.5 °C )是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2 + HNO3 =AgNO3+ HNO2。
(1)将5g在300°C下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002 mol NO2。反应12~36 min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为____________, 氯化钾需要“干燥”的原因是_____________。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。
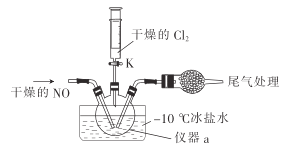
①仪器a的名称为__________。
②干燥管中盛放的试剂为____________。
③生成NOCl的化学方程式为________________。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
步骤 | 实验现象或反应的化学方程式 |
①取5ml三颈烧瓶中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O发应的化学方程式_______ |
②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为___________ |
③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为___________ |