题目内容
【题目】甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质。下列判断正确的是
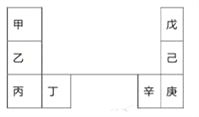
A. 金属性:甲>乙>丁 B. 原子半径:辛>己>戊
C. 丙和庚的原子核外电子数相差11 D. 乙的单质在空气中燃烧生成只含离子键的化合物
【答案】B
【解析】戊的一种单质是自然界硬度最大的物质,所以戊是C元素;则己、庚分别是Si、Ge元素;甲和戊的原子序数相差3,所以甲是Li元素,则乙、丙分别是Na、K元素;则丁是Ca元素,辛是Ga元素。A、根据元素周期律,同主族元素的金属性从上到下逐渐增强,所以金属性:甲<乙<丁,A错误;B、电子层数越多,原子半径越大,所以原子半径:辛>己>戊,B正确;C、丙的原子序数是19,庚的原子序数是32,所以原子的核外电子数的差值也即原子序数的差值,丙与庚的原子核外电子数相差13,C错误;D、Na在空气中燃烧生成过氧化钠,即含离子键又含共价键,D错误,答案选B。

【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1: 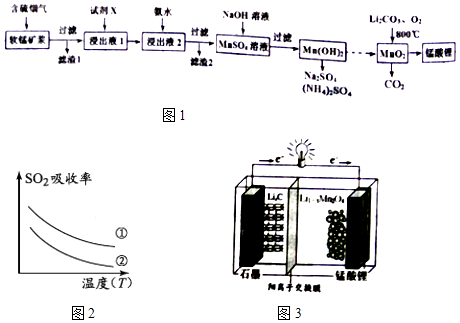
已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)已知:(图2)表二 表二
实验序号 | SO2浓度(gm﹣3) | 烟气流速(mLmin﹣1) |
① | 4.1 | 55 |
② | 4.1 | 96 |
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是 .
(4)锰酸锂可充电电池(图3)的总反应式为:Li1﹣xMnO4+LixC ![]() LiMnO4+C(x<1) ①放电时,电池的正极反应式为
LiMnO4+C(x<1) ①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.