题目内容
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造.以镍粉废料为原料制备Ni2O3的工艺如图1 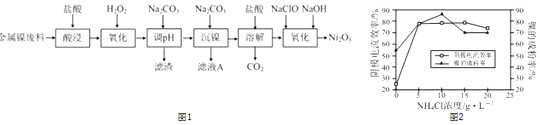
回答下列问题:
(1)Ni2O3中Ni的化合价为 .
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是 .
(3)加入H2O2“氧化”的离子方程式为;滤渣A的主要成分是(填化学式).
(4)工艺中分步加入Na2CO3的作用是;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为 .
(5)工业上,用镍为阳极,电解0.1mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉.当其他条件一定时,NH4Cl的浓度对阴极电流效率(电流效率是指电解时,在电极上实际沉积的物质的量与理论析出量之比)及镍的成粉率的影响如图2所示: ①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为mol/L.
②当NH4Cl溶液的浓度大于15g/L时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因: .
【答案】
(1)+3
(2)温度高,HCl挥发加快
(3)2Fe2++2H++H2O2=2Fe3++2H2O;Fe(OH)3
(4)将Fe3+和Ni2+分别沉淀出来;1:4
(5)0.2;随着NH4+浓度增大,水解平衡NH4++H2?NH3?H2O+H+ , 向右移动,H+浓度增大,导致阴极析出H2
【解析】解:(1)Ni2O3中氧元素﹣2价,化合物中化合价代数和为0,则Ni的化合价为+3;所以答案是:+3;(2)温度过高,HCl挥发,不利用金属离子的溶解;所以答案是:温度高,HCl挥发加快;(3)过氧化氢氧化亚铁离子为铁离子,发生的反应为:2Fe2++2H++H2O2=2Fe3++2H2O;加入碳酸钠溶液调节溶液的pH,使铁离子全部沉淀,则滤渣为Fe(OH)3;所以答案是:2Fe2++2H++H2O2=2Fe3++2H2O;Fe(OH)3;(4)工艺中分步加入Na2CO3的作用是将Fe3+和Ni2+分别沉淀出来,为提高原料的利用率,NaClO与NaOH“氧化”生成Ni2O3的离子方程式为2Ni2++ClO﹣+4OH﹣=Ni2O3↓+Cl﹣+2H2O,加入NaClO与NaOH的物质的量之比为 1:4; 所以答案是:将Fe3+和Ni2+分别沉淀出来;1:4;(5)①根据图2可知,NH4Cl的浓度为10gL﹣1时,镍的成粉率最高,所以NH4Cl的浓度最好控制为10 gL﹣1 , 浓度为 ![]() mol/L≈0.2mol/L;所以答案是:0.2;②当NH4Cl溶液的浓度大于15g/L时,随着NH4+浓度增大,水解平衡NH4++H2NH3H2O+H+ , 向右移动,H+浓度增大,导致阴极析出H2;所以答案是:随着NH4+浓度增大,水解平衡NH4++H2NH3H2O+H+ , 向右移动,H+浓度增大,导致阴极析出H2 .
mol/L≈0.2mol/L;所以答案是:0.2;②当NH4Cl溶液的浓度大于15g/L时,随着NH4+浓度增大,水解平衡NH4++H2NH3H2O+H+ , 向右移动,H+浓度增大,导致阴极析出H2;所以答案是:随着NH4+浓度增大,水解平衡NH4++H2NH3H2O+H+ , 向右移动,H+浓度增大,导致阴极析出H2 .