题目内容
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1: 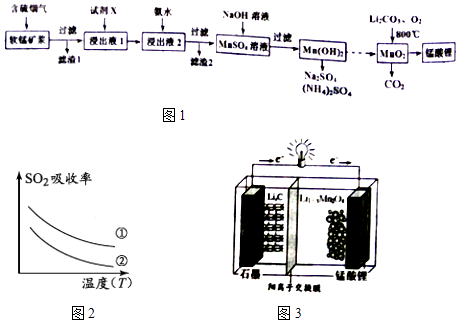
已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)已知:(图2)表二 表二
实验序号 | SO2浓度(gm﹣3) | 烟气流速(mLmin﹣1) |
① | 4.1 | 55 |
② | 4.1 | 96 |
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是 .
(4)锰酸锂可充电电池(图3)的总反应式为:Li1﹣xMnO4+LixC ![]() LiMnO4+C(x<1) ①放电时,电池的正极反应式为
LiMnO4+C(x<1) ①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.
【答案】
(1)ad
(2)H2O2
(3)除去铁、铝元素
(4)Li1﹣xMnO4+xLi++xe﹣=LiMn2O4;7
【解析】解:(1)a.降低通入含硫烟气的温度,可提高SO2吸收率.a正确;b.升高通入含硫烟气的温度,不能提高SO2吸收率.b错误;c.减少软锰矿浆的进入量,不能提高SO2吸收率.c错误;d.减小通入含硫烟气的流速,可提高SO2吸收率.d正确.所以答案是:ad;(2)将亚铁离子氧化成铁离子,应选择H2O2 , 所以答案是:H2O2;(3)加氨水调溶液pH在5~6之间,使Fe3+、Al3+阳离子转化为氢氧化铁、氢氧化铝沉淀而除去,所以答案是:除去铁、铝元素;(4)①根据总反应式可知Li失去电子,电池负极反应式为:xLi﹣xe﹣═xLi+ , 由总反应式减去负极反应式可得放电时的正极反应式为Li1﹣xMnO4+xLi++xe﹣═LiMnO4 , 所以答案是:Li1﹣xMnO4+xLi++xe﹣═LiMnO4;
②充电时,若转移1mole﹣ , 则石墨电极上产生1molLi,质量为1mol×7g/mol=7g,
所以答案是:7.