题目内容
【题目】化学与生产生活密切相关,下列说法不正确的是
A.用食盐、蔗糖等作食品防腐剂
B.用氧化钙作吸氧剂和干燥剂
C.用碳酸钙、碳酸镁和氢氧化铝等作抗酸药
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以保鲜
【答案】B
【解析】
A. 食盐、蔗糖能够使细菌脱水死亡,达到抑制细菌繁殖的目的,可做防腐剂,故A正确;
B. 氧化钙没有还原性,不能作吸氧剂,故B错误;
C. 碳酸钙、碳酸镁和氢氧化铝可与胃液中的盐酸反应,常用于作抗酸药,故C正确;
D. 乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用,为了延长水果的保鲜期,应除掉乙烯,所以将浸泡有酸性高锰酸钾溶液的硅藻土放置在盛放水果的容器中除去乙烯,故D正确;
故选B。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
已知:①CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.2kJmol﹣1
②CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣42.3kJmol﹣1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式 .
(2)为了探究反应条件对反应CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣42.3kJmol﹣1的影响,某活动小组设计了三个实验,实验曲线如图所示.
编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
Ⅰ | 530℃ | 3MPa | 1.0molL﹣1 | 3.0molL﹣1 |
Ⅱ | X | Y | 1.0molL﹣1 | 3.0molL﹣1 |
Ⅲ | 630℃ | 5MPa | 1.0molL﹣1 | 3.0molL﹣1 |
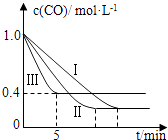
①请依据实验曲线图补充完整表格中的实验条件:X=℃,Y=MPa.
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=molL﹣1min﹣1 .
③实验Ⅱ达平衡时CO的转化率实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),此时化学反应将(填“向正方向”、“向逆方向”或“不”) 移动.
【题目】某化学兴趣小组设计如下方案测定饱和食盐水的电解率.
[提示:饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%]
(1)方案一:连接图甲、乙装置,在洗气瓶a中盛放足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率. 
正确的连接顺序为导管口(填“A”或“B”)连导管口C,若事先往甲装置的饱和食盐水中滴入酚酞,则电解过程甲装置中(填“铁棒”或“碳棒”)附近的溶液变红.
(2)电解饱和食盐水总反应的化学方程式为 .
(3)方案二:利用甲装置电解后的溶液,通过中和滴定来测定饱和食盐水的电解率.
部分实验过程如下:
①用(填“酸式滴定管”或“碱式滴定管”)量取10.00mL电解后的溶液,加入锥形瓶中;
②向锥形瓶中加入几滴酚酞试液,用0.2000molL﹣1标准盐酸滴定待测液,边滴边摇动锥形瓶,直到时停止滴定;
③该小组所测实验数据如表:
实验序号 | 盐酸体积(mL) |
第一组 | 19.90 |
第二组 | 24.70 |
第三组 | 20.10 |
第四组 | 20.00 |
未电解前饱和食盐水的物质的量浓度为5.4molL﹣1 , 经计算,求出该食盐水的电解率为
④下列操作,会导致实验结果偏低的是(填序号).
A.滴定时锥形瓶中液滴飞溅出来
B.滴定前读数时平视,终点读数时俯视
C.锥形瓶用蒸馏水洗净后没用待测液润洗
D.酸式滴定管尖端气泡没有排除,滴定后消失.