��Ŀ����
����Ŀ������������һ��ʱ��ͼ�����߱�ʾ��Ӧ2NO��g��+O2��g��2NO2��g����H��0��ƽ��ʱNO ��ת�������¶ȵĹ�ϵ��ͼ�ϱ���A,B,C,D,E�㣬�����й�˵����ȷ���ǣ� �� 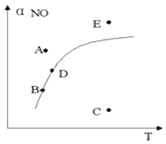
A.A�㷴Ӧδ�ﵽƽ��״̬���ҷ�Ӧ�����ƶ�
B.C��NOת������ͣ��һ�ѧ��Ӧ������С
C.B,D�����������Ӧ�¶��µĻ�ѧƽ��״̬���Ҧ�B��NO������D��NO��
D.E�㷴Ӧδ��ƽ�⣬��Ӧ�����ƶ���������ѹǿ����
���𰸡�C
���������⣺A��A��E��������Ӧ�¶��£����ߵ��Ϸ���NO��ת���ʸ�����Ӧ���¶�ƽ���NO��ת���ʣ���Ӧ���淴Ӧ���У���V����V�� �� ƽ�������ƶ�����A����
B��C������Ӧ�¶��£����ߵ��·���NO��ת����С����Ӧ�¶ȵ�ƽ���NO��ת���ʣ���Ӧ������Ӧ���У���V����V�� �� ƽ�������NOת���������¶�Խ�ͷ�Ӧ����ԽС������B��������С����B����
C����ͼ��֪��B��D���㴦�������ϣ�Ϊƽ��㣬����ƽ��״̬����V��=V�� �� �¶����ߣ�ƽ�������ƶ������Ԧ�B��NO������D��NO������C��ȷ��
D��E������Ӧ�¶��£����ߵ��Ϸ���NO��ת���ʸ�����Ӧ���¶�ƽ���NO��ת���ʣ���Ӧ���淴Ӧ���У���V����V�� �� ƽ�������ƶ�����D����
��ѡC��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����

 ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�����Ŀ�����ü�����ˮ��Ӧ�Ʊ���������ԭ�����۲����ʸߣ�����ʵ���ƹ��ֵ��
��֪����CH4��g��+H2O��g��CO��g��+3H2��g����H=+206.2kJmol��1
��CO��g��+H2O��g��CO2��g��+H2��g����H=��42.3kJmol��1
��1�������ˮ�������ɶ�����̼���������Ȼ�ѧ����ʽ ��
��2��Ϊ��̽����Ӧ�����Է�ӦCO��g��+H2O��g��CO2��g��+H2��g����H=��42.3kJmol��1��Ӱ�죬ij�С�����������ʵ�飬ʵ��������ͼ��ʾ��
��� | �¶� | ѹǿ | cʼ��CO�� | cʼ��H2O�� |
�� | 530�� | 3MPa | 1.0molL��1 | 3.0molL��1 |
�� | X | Y | 1.0molL��1 | 3.0molL��1 |
�� | 630�� | 5MPa | 1.0molL��1 | 3.0molL��1 |
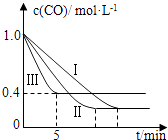
��������ʵ������ͼ�������������е�ʵ��������X=�棬Y=MPa��
��ʵ���ӿ�ʼ��ƽ�⣬��ƽ����Ӧ�ٶ���v ��CO��=molL��1min��1 ��
��ʵ����ƽ��ʱCO��ת����ʵ����ƽ��ʱCO��ת���ʣ�����ڡ�����С�ڡ����ڡ�����
����530��ʱ��ƽ�ⳣ��K=1������1L������Ͷ��0.2mol CO��g����0.2mol H2O��g����1mol CO2��g����0.1mol H2��g������ʱ��ѧ��Ӧ������������������淽������ �ƶ���