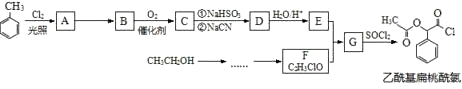
题目内容
【题目】(5分)短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是 。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为 。
(3)X、Y、Z三种元素组成的化合物中存在的化学键类型为 。
(4)Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为 。
【答案】(1)第三周期 第ⅦA族(1分) (2)![]() (1分)
(1分)
(3)离子键、共价键(2分) (4)H++OH-=H2O(1分)
【解析】试题分析:短周期元素X、Y、Z、W核电荷数依次增大,在周期表中X是原子半径最小的元素,则X为氢元素;Y的最外层电子数是内层电子数的3倍,Y元素元素有2个电子层,最外层电子数为6,故Y为氧元素;X、Z同主族,处于第ⅠA族,Z的原子序数大于氧元素,故Z为Na元素;四种元素的原子序数之和为37,故W的原子序数为37-11-8-1=17,故W为Cl元素,则
(1)Cl元素原子有3个电子层,最外层电子数为7,处于第三周期第ⅦA族;
(2)X与Y 能形成具有18个电子的化合物为H2O2,H2O2分子中氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对,电子式为:![]() ;
;
![]() (3)H、O、Na三种元素组成的化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,故NaOH中存在离子键、共价键;
(3)H、O、Na三种元素组成的化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,故NaOH中存在离子键、共价键;
(4)NaOH与高氯酸反应生成高氯酸钠与水,反应离子方程式为:H++OH-=H2O。

【题目】利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
已知:①CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.2kJmol﹣1
②CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣42.3kJmol﹣1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式 .
(2)为了探究反应条件对反应CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣42.3kJmol﹣1的影响,某活动小组设计了三个实验,实验曲线如图所示.
编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
Ⅰ | 530℃ | 3MPa | 1.0molL﹣1 | 3.0molL﹣1 |
Ⅱ | X | Y | 1.0molL﹣1 | 3.0molL﹣1 |
Ⅲ | 630℃ | 5MPa | 1.0molL﹣1 | 3.0molL﹣1 |
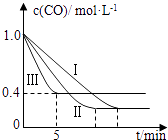
①请依据实验曲线图补充完整表格中的实验条件:X=℃,Y=MPa.
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=molL﹣1min﹣1 .
③实验Ⅱ达平衡时CO的转化率实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),此时化学反应将(填“向正方向”、“向逆方向”或“不”) 移动.
【题目】某化学兴趣小组设计如下方案测定饱和食盐水的电解率.
[提示:饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%]
(1)方案一:连接图甲、乙装置,在洗气瓶a中盛放足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率. 
正确的连接顺序为导管口(填“A”或“B”)连导管口C,若事先往甲装置的饱和食盐水中滴入酚酞,则电解过程甲装置中(填“铁棒”或“碳棒”)附近的溶液变红.
(2)电解饱和食盐水总反应的化学方程式为 .
(3)方案二:利用甲装置电解后的溶液,通过中和滴定来测定饱和食盐水的电解率.
部分实验过程如下:
①用(填“酸式滴定管”或“碱式滴定管”)量取10.00mL电解后的溶液,加入锥形瓶中;
②向锥形瓶中加入几滴酚酞试液,用0.2000molL﹣1标准盐酸滴定待测液,边滴边摇动锥形瓶,直到时停止滴定;
③该小组所测实验数据如表:
实验序号 | 盐酸体积(mL) |
第一组 | 19.90 |
第二组 | 24.70 |
第三组 | 20.10 |
第四组 | 20.00 |
未电解前饱和食盐水的物质的量浓度为5.4molL﹣1 , 经计算,求出该食盐水的电解率为
④下列操作,会导致实验结果偏低的是(填序号).
A.滴定时锥形瓶中液滴飞溅出来
B.滴定前读数时平视,终点读数时俯视
C.锥形瓶用蒸馏水洗净后没用待测液润洗
D.酸式滴定管尖端气泡没有排除,滴定后消失.