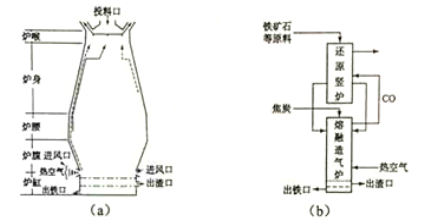
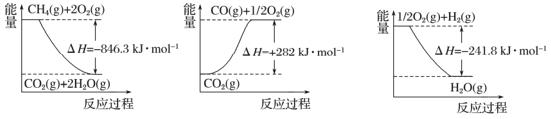
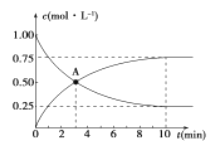
��Ŀ����
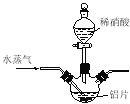
����Ŀ������ͼ��ʾ��һ����ȡ������������Ϊԭ�Ͻ����ض���Ӧ��װ�ã��������������������bƿ�У����и��Լ�ƿ����װ�Լ�Ϊ��B(������)��C(�⻯�ص�����Һ)��D(ˮ)��F(��ɫʯ����Һ)��
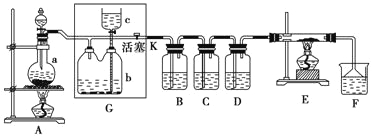
��1����A����ƿ�еĹ���ΪMnO2��Һ��ΪŨ���ᣬ���䷢����Ӧ�Ļ�ѧ����ʽΪ______��
��2����μ��װ��G�������ԣ�______��д����������������
��3��G��bƿ���˼����Һ����______��ʵ�鿪ʼ��B�е�������______��C�е�������______��F��������______��
��4��Eװ����Ӳ�ʲ�������ʢ��̿�ۣ���E�з���������ԭ��Ӧ�������Ϊ������̼���Ȼ��⣬д��E�з�Ӧ�Ļ�ѧ����ʽ��__________________________________________��
��������1��MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��2���ر�A�з�Һ©������G�л���K������ֹˮ�м�סA��G�����Ƥ�ܲ��ر�G�л���K������c�������ڼ�ˮ��c���¶˽���ҳ����c��Һ�����bƿ��Һ�棬��һ��ʱ���c��Һ�治�½�����Һ���ֲ��䣩����˵�������Ժ� ��3������ʳ��ˮ
�����ռ�����ɫ��Ϊ����ɫ����dz��ɫ��������
�ϲ��ռ�����ɫ��Ϊ����ɫ����Һ����ɫ
��ɫʯ����Һ����ɫ����ɫ��Ϊ��ɫ���ٱ�Ϊ��ɫ
��4��C+2Cl2+2H2O��g��![]() CO2+4HCl
CO2+4HCl
��������
�����������1��Aװ�õ���������ȡ�������仯ѧ��Ӧ����ʽΪMnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
��2���ؼ�װ��G���ص���ж��������������������ǹر�A�з�Һ©������G�л���K������ֹˮ�м�סA��G�����Ƥ�ܲ��ر�G�л���K������c�������ڼ�ˮ��c���¶˽���ҳ����c��Һ�����bƿ��Һ�棬��һ��ʱ���c��Һ�治�½�����Һ���ֲ��䣩����˵�������Ժ���
��3��G���������ռ�������Aװ���в�������������HCl�����ܶ�ʵ�����Ӱ�죬�����ȥ�����b�е��Լ��ñ���ʳ��ˮ�������ǻ���ɫ���壬����ǿ�����ԣ���������������B����ʵ�������������ռ�����ɫ��Ϊ����ɫ����dz��ɫ���������������ܰѵ⻯������Ϊ�⣬������������ɫ����C����ʵ���������ϲ��ռ�����ɫ��Ϊ����ɫ����Һ����ɫ��������������������Һ��Ӧ����F����ʵ����������ɫʯ����Һ����ɫ����ɫ��Ϊ��ɫ���ٱ�Ϊ��ɫ��
��4��������CO2��HCl����˷�Ӧ��C��Cl2��CO2��HCl��C��0����4����4��Cl2��0����1����2����С������Ϊ4����C��2Cl2��CO2��4HCl����Ӧ����Ӧ��4��H��2��O����2��H2O����˷�Ӧ����ʽΪC+2Cl2+2H2O��g��![]() CO2+4HCl��
CO2+4HCl��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
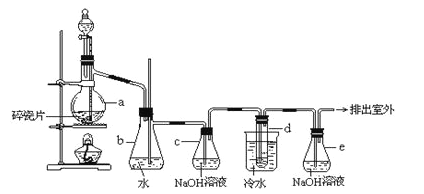
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ʵ���Ҳ��ü���װ��ģ����ʾ��ҵ����ԭ����ʵ��װ��ͼ��ʵ�鲽�����£�
![]()
![]()
![]()
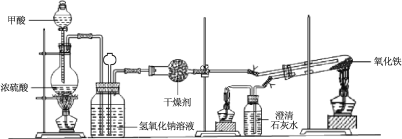
�� ����ͼ���Ӻ�װ�ã����װ�������ԡ�
�� ��ȡ���� Fe2O3��ʯӢ�Թ��У���ȼ�����ƾ��ƣ�����������ᡣ
�� �����ij�������ȼ���������ƾ��ơ�
�� 30 min��Ϩ��ƾ��ƣ��رյ��ɼС�
�� ��������ȴ�����º��ռ����
�� �������Ϸ����ֱ��ռ����������־ƾ��ƣ��������ֿ��Լ��л��桢����¶ȣ��;ƾ���Ƽ��ȵIJ��
��ش��������⣺
��1���Ʊ�CO��ԭ�������ü��ᣨHCOOH����Ũ������������µķֽ��Ƶã�ʢ�ż������������Ϊ ���÷�Ӧ�Ļ�ѧ����ʽ ��
��2��ʵ�鲽����ij�������ָ ��
��3��ʵ�鲽����Ϩ��ƾ��Ƶ�˳��Ϊ______________������I��II��III��
��4��ͨ�������ϻ�ȡ������Ϣ��
I���ƾ���ƽ���¶�Ϊ600���������־ƾ���ƽ���¶�Ϊ700�����ƾ����ƽ���¶�Ϊ930����
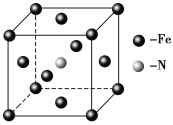
II������ָ������Ӧ�¶ȸ���710����Fe���ȶ����ڣ�680����710��֮�䣬FeO�ȶ����ڣ�����680��������Ҫ��Fe3O4���Է����ƾ��Ƽ�������������Fe��ԭ���� ��
��5����֪FeO��Fe2O3��Fe3O4��Ԫ�ص����������ֱ�Ϊ��22.2%��30%��27.6%�����������������3����Ʒ����Ԫ�������Ԫ�ص������������±���
���ȷ�ʽ | ����Ԫ����� | ��Ԫ�ص���������%[��������] | |
Fe | O | ||
�ƾ��� | Fe��O | 74.50 | 25.50 |
�����־ƾ��� | Fe��O | 76.48 | 23.52 |
�ƾ���� | Fe | 100.00 | 0.00 |
������Ԫ�ص�����������֪ǰ���ּ��ȷ�ʽ�õ��IJ���Ϊ�������оƾ��Ƽ������ò������������_______�ֿ��ܡ�
��6��ͨ����һ���������������ǰ���ּ��ȷ�ʽ�õ��Ĺ����ĩ�ɷ־�ΪFe3O4��Fe���þƾ���Ƽ��ȵõ��Ĺ����ĩ�ɷ�ΪFe����������þƾ��Ƽ��ȷ�ʽ�������Fe3O4��Fe��������Ϊ_____����Ҫ����������