题目内容
【题目】已知298 K时,合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在体积为2L的密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ;原因是
2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在体积为2L的密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ;原因是
如果反应5分钟达到平衡时气体总物质的量为2.5mol,则这段时间内氢气的反应速率为 ,达平衡时氮气的转化率为 。
【答案】小于 N2和H2的反应是可逆反应,1 mol N2和3 mol H2充分反应生成的NH3一定小于2 mol,故放出的热量小于理论计算值 0.225mol/(L.min) 75﹪
【解析】
试题分析:N2(g)+3H2(g)![]() 2NH3(g)反应可逆,取1 mol N2(g)和3 mol H2(g)在体积为2L的密闭容器中充分反应生成氨气的物质的量小于2mol,放出的热量小于92.4 kJ;
2NH3(g)反应可逆,取1 mol N2(g)和3 mol H2(g)在体积为2L的密闭容器中充分反应生成氨气的物质的量小于2mol,放出的热量小于92.4 kJ;
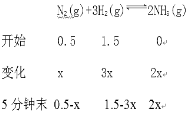
(0.5-x) + (1.5-3x) + 2x=1.25
X=0.375
![]() 0.225mol/(L.min);
0.225mol/(L.min);
达平衡时氮气的转化率为=![]() =75﹪。
=75﹪。

练习册系列答案
相关题目