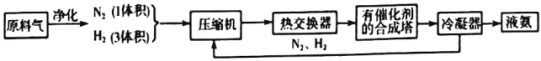
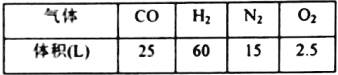
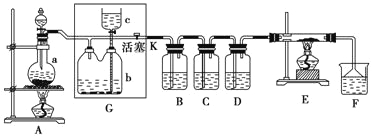
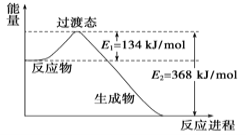
��Ŀ����
����Ŀ��ԭ���������ε����Ҷ�С��36��A��B��C��D��E����Ԫ�أ�����A��һ�ֺ�����û�����ӣ�Bԭ�ӻ�̬ʱ���������������ڲ��������2����Dԭ�ӻ�̬ʱ2pԭ�ӹ������2��δ�ɶԵĵ��ӣ�EԪ�ص�ԭ�ӽṹ��3d�ܼ���δ�ɶԵ������dzɶԵ�������2�����ش��������⣺
��1��B2A4������Bԭ�ӹ�����ӻ�����Ϊ ��B2A4�����ЦҼ��ͦм�������Ϊ ��
��2��A��B��C��D����Ԫ�صĵ縺�ԴӴ�С��˳��Ϊ______________����Ԫ�ط��ű�ʾ����������CA3�ķе�Ȼ�����BA4�ĸߣ�����Ҫԭ���� ��
��3��Ԫ��B��һ����������Ԫ��C��һ�������ﻥΪ�ȵ����壬Ԫ��C������������ķ���ʽ�� ��
��4��Ԫ��E���γɶ��������磺E(CO)5�ȡ�
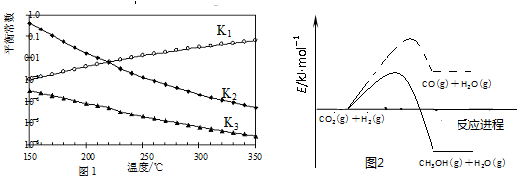
�ٻ�̬Eԭ�ӵļ۵����Ų�ͼΪ ��
��E(CO)5�����³�Һ̬���۵�Ϊ��20.5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��ж�E(CO)5�������� ��������ͣ����þ�����E�Ļ��ϼ�Ϊ ��
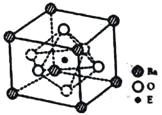
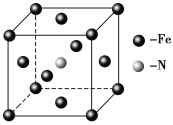
��5��E��C�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ���þ����Ļ�ѧʽΪ_______�������������Eԭ�Ӽ�ľ���Ϊacm����þ�����ܶ���______g��mL-1��
���𰸡���1��sp2�ӻ���5:1����2��O>N>C>H,NH3������������3��N2O����4��![]() ��
��
���Ӿ��壬0����5��Fe4N��![]() .
.
��������
���������ԭ���������ε����Ҷ�С��36��A��B��C��D��E����Ԫ�أ�����A��һ�ֺ�����û�����ӣ�A��HԪ�أ�Bԭ�ӻ�̬ʱ���������������ڲ��������2����B��CԪ�أ�Dԭ�ӻ�̬ʱ2pԭ�ӹ������2��δ�ɶԵĵ��ӣ�����B��CԪ�أ�����D��OԪ�أ�C��NԪ�أ�EԪ�ص�ԭ�ӽṹ��3d�ܼ���δ�ɶԵ������dzɶԵ�������2����E��FeԪ�أ���1��C2H4������Cԭ�ӹ�����ӻ�����Ϊsp2�ӻ������ۼ������ǦҼ���˫������һ���Ǧм�����һ���ǦҼ���������ϩ�����ЦҼ��ͦм�������Ϊ5:1����Ϊ��sp2�ӻ���5:1����2����2��A��B��C��D����Ԫ�صĵ縺�ԴӴ�С��˳��ΪO>N>C>H,NH3�д��ڷ��Ӽ�������Էе�Ȼ�����CH4�ĸ�,��Ϊ��O>N>C>H,NH3������������3��N��һ���������C��һ�������ﻥΪ�ȵ����壬��ô�ֱ���N2O��CO2����Ϊ��N2O����4��Ԫ��E��FeԪ�أ��ٻ�̬Eԭ�ӵļ۵����Ų�ͼΪ![]() ����E(CO)5�����³�Һ̬���۵�Ϊ��20.5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��ж�E(CO)5�������ڷ��Ӿ��壬�þ�����E�Ļ��ϼ�Ϊ0����Ϊ��
����E(CO)5�����³�Һ̬���۵�Ϊ��20.5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��ж�E(CO)5�������ڷ��Ӿ��壬�þ�����E�Ļ��ϼ�Ϊ0����Ϊ��![]() �����Ӿ��壬0����5��Fe��N�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ���þ�����Feԭ��λ�ڶ�������ģ������Ϊ8��
�����Ӿ��壬0����5��Fe��N�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ���þ�����Feԭ��λ�ڶ�������ģ������Ϊ8��![]() +6��
+6��![]() =4��Nԭ��λ�����ģ�ԭ�Ӹ���Ϊ1���������Ļ�ѧʽΪFe4N�������������Feԭ�Ӽ�ľ���Ϊacm,����Խ��ߵ�1/2Ϊacm����ô�ⳤΪ
=4��Nԭ��λ�����ģ�ԭ�Ӹ���Ϊ1���������Ļ�ѧʽΪFe4N�������������Feԭ�Ӽ�ľ���Ϊacm,����Խ��ߵ�1/2Ϊacm����ô�ⳤΪ![]() acm����þ�����ܶ���
acm����þ�����ܶ���![]() g��mL-1����Ϊ��Fe4N��
g��mL-1������Fe4N��![]() .
.

 �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�