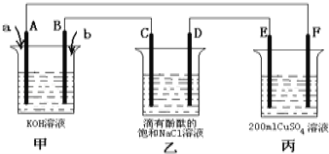
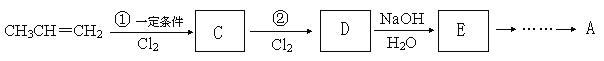
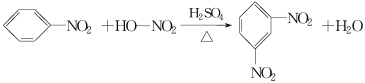��Ŀ����
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ�A��B��C��D��E��FΪԪ�����ڱ�ǰ�����ڵ�Ԫ�أ�ԭ��������������AԪ�صĵ����ǿ�������Ҫ�ɷ֣�Bԭ�Ӻ���p�������1�ԳɶԵ��ӣ�DԪ�صļ۵������������������һ�룬C��Bͬ���壬A��Fͬ���壬D��Eͬ�塣�ش��������⣺
��1��A��B��C��һ�������ɴ�С��˳��Ϊ�� ����Ԫ�ط��ű�ʾ����
��2��B��C�γɵĶ�Ԫ�������У����ڷǼ��Է��ӵ��ǣ� ���ѧʽ�����÷�������ԭ�ӵ��ӻ�����Ϊ�� ��
��3��A��CԪ���γɵij����������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ4������ �����ѧʽ����ͬ�������ƽ�������ε����� ��
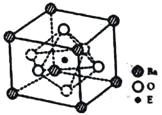
��4��E��F�γɵ�һ�ֻ�����ľ���ṹ��ͼ��ʾ����û�����Ļ�ѧʽΪ ��F����λ��Ϊ ��
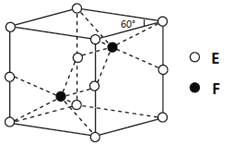
��5��D�����ӿ����γɶ���������Dn+��Br-��C��
��ۺ��������A�ļ��⻯���γɵ�1:1:1:5��ij
���������������Һ�еμ�AgNO3��Һ����
����ɫ�������μ�BaCl2��Һ��������������Ļ�ѧʽΪ�� ��nֵΪ ��Dn+�Ļ�̬�����Ų�ʽΪ�� ��
���𰸡���1��N��O��S��2�֣���2��SO3��1�֣� sp2��1�֣���3��H2SO3��H2SO4 ��2�֣� HNO3��1�֣�
��4��NiAs��2�֣� 6��1�֣�
��5��[CoSO4(NH3)5]Br��2�֣� 3��1�֣�1s22s22p63s23p63d6��[Ar]3d6��2�֣�
�����������������A��B��C��D��E��FΪԪ�����ڱ�ǰ�����ڵ�Ԫ�أ�ԭ��������������Bԭ�Ӻ���p�������1�ԳɶԵ��ӣ���Χ�����Ų�Ϊns2np4��������A�壬AԪ�صĵ����ǿ�������Ҫ�ɷ֣�ԭ������С��B����AΪNԪ�أ�����C��Bͬ���塢A��Fͬ���壬F��ԭ����������C����F��C���ܴ���ͬ���ڣ�FӦ����C����һ���ڣ���B��C��F�ֱ�Ϊ�������������ڣ���BΪOԪ�ء�CΪSԪ�ء�FΪAs��D��Eͬ�壬D��Eԭ����������S��С��As��ֻ��Ϊ����Ԫ�أ�DԪ�صļ۵������������������һ�룬�۵�����Ϊ(2+8+8)��2=9����DΪCo����EΪNi��
��1��ͬ������ԭ����������һ�����ܳ��������ƣ���NԪ��2p�ܼ�����3�����ӣ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ�ͬ�������϶��µ�һ�����ܼ�С���ʵ�һ�����ܣ�N��O��S��
��2��B��C�γɵĶ�Ԫ��������SO2��SO3��SO2������Sԭ�ӹµ��Ӷ���Ϊ(6-2��2)/2=1���۲���Ӷ���Ϊ2+1=3��ΪV�νṹ������������������IJ��غϣ����ڼ��Է��ӣ�SO3������Sԭ�ӹµ��Ӷ���Ϊ(6-2��3)/2=0���۲���Ӷ���Ϊ3+0=3��Ϊƽ���������νṹ��������������������غϣ����ڷǼ��Է��ӣ�Sԭ�Ӳ�ȡsp2�ӻ���
��3��A��CԪ���γɵij����������������ᡢ���ᡢ�����ᡢ���ᣬ���ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ4������H2SO3��H2SO4��������е�Ԫ�صļ۲���Ӷ�����3���Ҳ����ڹ¶Ե��ӣ���������ƽ�������ε��������ᣬ��ѧʽΪHNO3��
��4��EΪNi��FΪAs���ɾ����ṹ��֪�������к���2��Asԭ�ӣ�����Niԭ����ĿΪ8��1/8+4��1/4=2���ʸû����ﻯѧʽΪNiAs��Fԭ������Χ��6��Eԭ���γ����ڣ�F��λ��Ϊ6��
��5��C����ۺ������ΪSO42-��A�ļ��⻯��ΪNH3����Con+��Br-��SO42-��NH3�γɵ�1��1��1��5��ij�����ɵ���غ��֪n=3��Con+ΪCo3+�������������Һ�еμ�AgNO3��Һ��������ɫ�������μ�BaCl2��Һ������˵��������������ڽ磬������Ϊ��������磬���Ը�����ﻯѧʽʽΪ[Co(SO4)(NH3)5]Br��Co3+�Ļ�̬�����Ų�ʽΪ1s22s22p63s23p63d6��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�