题目内容
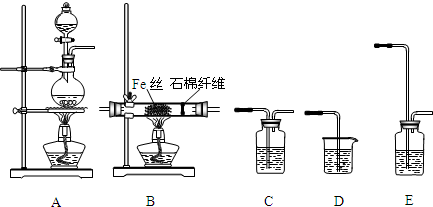
7.乙醚极易挥发、微溶于水、是良好的有机溶剂.乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚.某实验小组用下图装置制取乙醚和乙烯.
有关物质沸点数据
| 物质 | 沸点 |
| 乙醚 | 34.6℃ |
| 乙醇 | 78.2℃ |
①Ⅰ和Ⅱ是反应发生装置,应该选择Ⅰ(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连.
②乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是防止乙醇挥发.
③Ⅲ中水冷凝管的进水口是b(选答“a”或“b”).冰盐水的作用是凝液化乙醚.
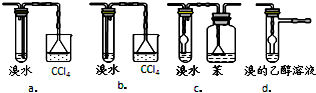
④有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险.该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)c、d.
⑤反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色.写出实验过程中有气体生成的化学方程式(写两个方程式)CH3CH2OH+6H2SO4$\stackrel{△}{→}$2CO2↑+6SO2↑+↑+2H2O;C+2H2SO4$\stackrel{△}{→}$CO2↑+2SO2↑+2H2O、CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O、CH3CH2OH+2H2SO4$\stackrel{△}{→}$2C+2SO2↑+5H2O(其中两个).
⑥实验中收集到的乙醚产品中可能含有多种杂质.某同学设计了以下提纯方案:
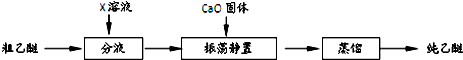
(2)分液步骤除去产品中的酸性杂质,则X可以是NaOH.
(3)蒸馏操作可除去的杂质是乙醇(CH3CH2OH).
分析 (1)①制取乙醚的温度是混合液的温度为140℃;
②乙醇具有挥发性,根据乙醇的性质来确定实验目的;
③根据逆流冷却的效果较好判断进水口,根据乙醚的沸点判断冰盐水的作用;
④根据气压原理和重力原理来选择防止倒吸的装置;
⑤乙醇和浓硫酸在一定的温度下发生消去反应生成乙烯,浓硫酸会将乙醇氧化为二氧化碳或是碳单质等;
(2)和酸性物质可以反应的是碱液;
(3)蒸馏可以将沸点不同的物质进行分离.
解答 解:(1)①制取乙醚的温度是控制混合液的温度为140℃,温度计的水银球要插在液面以下,故选装置Ⅰ,故答案为:Ⅰ;
②乙醇具有挥发性,要通过分液漏斗下端连接的长导管插入到液面下加入,故答案为:防止乙醇挥发;
③逆流冷却的效果较好,所以进水口为b,根据乙醚的沸点可知,冰盐水的作用是冷凝液化乙醚,加以收集,故答案为:b;凝液化乙醚;
④c、d是可以防止倒吸的装置,并且可以实现乙醚的分离,a中不能将溴乙烷和乙醚分离开来,b装置会导致倒吸现象,故选c、d;
⑤乙醇和浓硫酸在一定的温度下发生消去反应生成乙烯,浓硫酸的强氧化性会将乙醇氧化为二氧化碳或是碳单质等,发生的化学反应有:CH3CH2OH+6H2SO4$\stackrel{△}{→}$2CO2↑+6SO2↑+9H2O;C+2H2SO4$\stackrel{△}{→}$CO2↑+2SO2↑+2H2O;CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O;CH3CH2OH+2H2SO4$\stackrel{△}{→}$2C+2SO2↑+5H2O,
故答案为:CH3CH2OH+6H2SO4$\stackrel{△}{→}$2CO2↑+6SO2↑+9H2O、C+2H2SO4$\stackrel{△}{→}$CO2↑+2SO2↑+2H2O、CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O、CH3CH2OH+2H2SO4$\stackrel{△}{→}$2C+2SO2↑+5H2O(其中两个);
(2)分液步骤除去产品中的酸性杂质可以用碱液,如氢氧化钠,
故答案为:NaOH;
(3)蒸馏可以将沸点不同的物质进行分离,乙醇的沸点较低,可用蒸馏的方法除去乙醚中的乙醇,
故答案为:乙醇(CH3CH2OH).
点评 本题重点考查学生乙醇的化学性质,结合实验考查增加了试题的难度,综合性强,要求学生具有分析和解决问题的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 单质的密度都很小,属于轻金属,且随核电荷数的增加依次增大 | |
| B. | 单质的熔点都很低,导电性、导热性都很好,如液态钠可作核反应堆的传热介质 | |
| C. | 单质与氧气反应时都只能生成氧化物或过氧化物 | |
| D. | 在Na、K、Rb三种单质中,Rb的熔点最高 |
| A. | 萃取 | B. | 溶解 | C. | 蒸发 | D. | 过滤 |
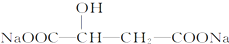 )可作为调味剂、缓冲剂、保水剂以及防腐保鲜剂,广泛应用于饮料、肉制品、口服液等.有关说法错误是( )
)可作为调味剂、缓冲剂、保水剂以及防腐保鲜剂,广泛应用于饮料、肉制品、口服液等.有关说法错误是( )| A. | 苹果酸的酸性强于醋酸 | |
| B. | 分别对苹果酸、苹果酸钠溶液微热,溶液的pH均增大 | |
| C. | 苹果酸在一定条件下发生消去反应可生成HOOCCH═CHCOOH | |
| D. | 苹果酸在一定条件下发生取代反应可生成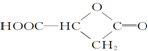 |
| A. | 0.1 mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 使石蕊试液变红的溶液:Ca2+、Na+、ClO-、NO3- |
| A. | 0.225 | B. | 0.30 | C. | 0.36 | D. | 0.45 |