题目内容
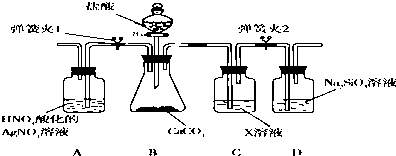
9.一氯胺(NH2Cl,Cl呈+1价)可用于制备液体火箭燃料偏二甲肼.实验室制备一氯胺可用氨气与次氯酸或次氯酸盐反应,某实验小组设计如下装置制备NH2Cl.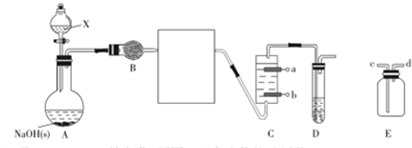
(1)试剂X是浓氨水(填名称,下同),B中盛装的试剂是碱石灰或者生石灰.
(2)E置于B、C之间,可用于收集制备的气体,收集时,气体从d(填“c”或“d”)口进气.
(3)若C中盛装的是饱和食盐水,则惰性电极b应与电源正极相连.
(4)电解一段时间后,通入氨气,写出氨气与次氯酸钠反应生成NH2Cl的化学方程式:NaClO+NH3=NH2Cl+NaOH.
(5)一氯胺是重要的水消毒剂,利用碘量法可以检测自来水中一氯胺的含量.其主要方法为:取已加入一氯胺的自来水20.00ml,加入过量的碘化钾溶液,充分反应后,用0.100mol/L的Na2S2O3溶液进行滴定,达到终点时,消耗Na2S2O3溶液5.00ml.则该自来水中一氯胺的浓度为0.0125mol•L-1.
已知:NH2Cl+3I-+2H2O═NH3•H2O+OH-+Cl-+I3- I3-≒I2+I- I2+2S2O32-═2I-+S4O62-.
分析 (1)该实验中用浓氨水与氢氧化钠制氨气,B中盛装是净化碱性气体氨气中的水,所以选用的试剂是碱石灰或者生石灰;
(2)装置E用收集气体时,如气体的密度比空气小用向上排空法,即d进c出;
(3)b极应产生氯气与a极产生的氢氧化钠充分接触生成次氯酸钠;
(4)氨气与次氯酸钠发生氧化还原反应生成一氯胺,反应的方程式为:NaClO+NH3=NH2Cl+NaOH;
(5)由方程式:NH2Cl+3I-+2H2O═NH3•H2O+OH-+Cl-+I3-;I3-≒I2+I-;I2+2S2O32-═2I-+S4O62-;可得到关系式:NH2Cl~I3-~I2~2S2O32-进行计算.
解答 解:(1)该实验中用浓氨水与氢氧化钠制氨气,所以试剂X是浓氨水,B中盛装是净化碱性气体氨气中的水,所以选用的试剂是碱石灰或者生石灰,
故答案为:浓氨水;碱石灰或者生石灰;
(2)E置于B、C之间,可用于收集制备未完全反应的氨气,收集时,应d进c出,
故答案为:d;
(3)b极应产生氯气与a极产生的氢氧化钠充分接触生成次氯酸钠,氯由-1价变成0价的氯,化合价升高发生氧化反应,所以b是阳极,与电源的正极相连,
故答案为;正;
(4)氨气与次氯酸钠发生氧化还原反应生成一氯胺,反应的方程式为:NaClO+NH3=NH2Cl+NaOH,故答案为:NaClO+NH3=NH2Cl+NaOH;
(5)由方程式:NH2Cl+3I-+2H2O═NH3•H2O+OH-+Cl-+I3-;I3-≒I2+I-;I2+2S2O32-═2I-+S4O62-;可得到关系式:
NH2Cl~I3-~I2 ~2S2O32-;
1 2
C×20×10-3L 0.100mol/L×5×10-3L
解之得:C=$\frac{0.100mol/L×5×1{0}^{-3}L}{2×20×1{0}^{-3}L}$=0.0125mol/L,
故答案为:0.0125.
点评 本题是一道综合考查题,有关于制备液体火箭燃料偏二甲肼的制备的题目和氧化还原反应滴定的计算,难度中等,注意利用关系式计算.

| A. | 将Fe(OH)3和水充分搅拌,滴加酚酞试液溶液变红色 | |
| B. | 在FeCl3溶液中滴加KSCN溶液,产生血红色沉淀 | |
| C. | 在酸性FeSO4溶液中滴加KMnO4 溶液至反应完全,溶液呈无色 | |
| D. | 在FeCl3溶液中加入铜粉能溶解 |
| A. | H2O2溶液与酸性KMnO4溶液反应:2MnO4-+3H2O2+6H+═2Mn2++6H2O+4O2↑ | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2NO2-+8H++6I-═3I2+2NO↑+4H2O | |
| C. | 少量SO2通入碳酸钠溶液中:CO32-+SO2═CO2+SO32- | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO32-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
| 分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 500g•L-1 |
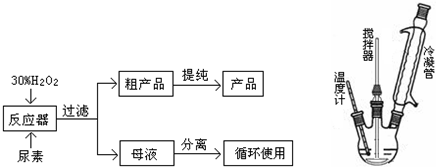
请回答下列问题:
(1)写出合成过氧化尿素的化学方程式:CO(NH2)2+H2O2=CO(NH2)2•H2O2.
(2)反应器里冷凝管中冷水从下(填“上”或“下”)口流入;反应器的加热方式是②.
①直接加热;②水浴加热;③蒸气浴加热;④冰浴
(3)搅拌器选用的材料是玻璃而不是铁质或铝质材料的原因是铁铝易被(过氧化氢)腐蚀.
(4)从母液中分离出H2O2和尿素,采用的是减压蒸发、冷却结晶的方法,其原因是降低蒸馏温度,防止过氧化氢分解.
(5)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%).为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:
①完成并配平下列化学方程式;
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2
②KMnO4溶液应盛放在酸式滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量偏高(填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量不合格(填“合格”或“不合格”),活性氧的质量分数为12%..
| A. | 2mol/l | B. | 4mol/l | C. | 1 mol/l | D. | 20mol/l |
| A. | 缩小容器体积,使压强增大 | B. | 压强不变,充入N2 | ||
| C. | 体积不变,充入He使压强增大 | D. | 减小压强,使容器体积增大 |
| A. | 单质的密度都很小,属于轻金属,且随核电荷数的增加依次增大 | |
| B. | 单质的熔点都很低,导电性、导热性都很好,如液态钠可作核反应堆的传热介质 | |
| C. | 单质与氧气反应时都只能生成氧化物或过氧化物 | |
| D. | 在Na、K、Rb三种单质中,Rb的熔点最高 |