题目内容
【题目】实验室利用二氧化锰和浓盐酸反应制取Cl2,化学方程式如下:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)请用单线桥标出该反应电子转移的方向和数目__,该反应的氧化产物是__。
(2)其中氧化剂与还原剂的物质的量之比是__;若实验中有87g的MnO2完全反应,则制得的Cl2在标况下的体积是__L。
【答案】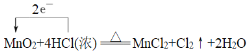 Cl2 1:2 22.4
Cl2 1:2 22.4
【解析】
反应中Mn元素化合价从+4价降低到+2价,Cl元素化合价从-1价升高到0价,结合电子得失守恒以及氧化还原反应的有关概念分析解答。
(1)反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中Mn元素的化合价由+4降低为+2价,得到2个电子,Cl元素的化合价由-1升高为0价,失去1个电子,则根据电子得失守恒可知转移的电子数为2个,因此单线桥法标出该反应电子转移的方向和数目为
MnCl2+Cl2↑+2H2O中Mn元素的化合价由+4降低为+2价,得到2个电子,Cl元素的化合价由-1升高为0价,失去1个电子,则根据电子得失守恒可知转移的电子数为2个,因此单线桥法标出该反应电子转移的方向和数目为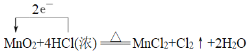 ,其中该反应的氧化产物是Cl2;
,其中该反应的氧化产物是Cl2;
(2)根据电子得失守恒可知氧化剂与还原剂的物质的量之比是1:2;若实验中有87g的MnO2完全反应,二氧化锰的物质的量是1mol,则制得的Cl2是1mol,在标况下的体积是22.4L。

练习册系列答案
相关题目