题目内容
【题目】已知非金属元素A、B、C、D、E均属于短周期元素,其原子序数依次增大,A元素原子形成的离子核外电子数为零,B原子的最外层电子数是内层电子数的2倍,通常状况下E的单质是黄色晶体,不溶于水,易溶于二硫化碳,D与E在同一主族,C、D在周期表中处于相邻的位置,请回答下列问题:
(1)B元素的名称是___,E的阴离子结构示意图是___。
(2)A元素与元素周期表中非金属性最强的元素形成化合物M,M溶液常被用来刻蚀玻璃,刻蚀玻璃的化学方程式为____。
(3)元素C的最高价氧化物对应水化物与其气态氢化物反应生成化合物Z,该反应的离子方程式为____,形成化合物Z的阳离子在实验室中如何检验?简述操作步骤。____。
【答案】碳 ![]() SiO2+4HF=SiF4↑+2H2O NH3+H+=NH4+ 取适量化合物Z于一试管中,滴加NaOH溶液充分反应,微热,在试管口置一湿润的红色石蕊试纸,试纸变蓝
SiO2+4HF=SiF4↑+2H2O NH3+H+=NH4+ 取适量化合物Z于一试管中,滴加NaOH溶液充分反应,微热,在试管口置一湿润的红色石蕊试纸,试纸变蓝
【解析】
已知非金属元素A、B、C、D、E均属于短周期元素,其原子序数依次增大,A元素原子形成的离子核外电子数为零,则A为H元素;B原子的最外层电子数是内层电子数的2倍,则B总共有2个电子层,核外电子排布为2,4,则B为碳元素;通常状况下E的单质是黄色晶体,不溶于水,易溶于二硫化碳,则E为S元素;D与E在同一主族,且D的原子序数小于E,则D为O元素;C、D在周期表中处于相邻的位置,且C的原子序数小于D,则C为N元素;据此分析解答。
(1)由以上分析可知,B为C元素,元素名称为碳,E为S元素,其阴离子为硫离子,离子结构示意图为: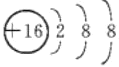 ;
;
(2)元素周期表中非金属性最强的元素为氟元素,其与氢元素形成的化合物M为HF,玻璃的主要成分为二氧化硅,则用HF溶液蚀刻玻璃的化学反应方程式为:SiO2+4HF=SiF4↑+2H2O;
(3)由以上分析可知,C为N元素,其最高价氧化物对应水化物为硝酸,其气态氢化物为氨气,氨气与硝酸反应的化合物Z为硝酸铵,反应的离子方程式为:NH3+H+=NH4+,硝酸铵由铵根离子和硝酸根离子构成,属于离子化合物,铵根离子与碱加热会生成氨气,氨气为碱性气体,能使湿润的红色石蕊试纸变蓝,故检验铵根离子的操作步骤为:取适量化合物Z于一试管中,滴加NaOH溶液充分反应,微热,在试管口置一湿润的红色石蕊试纸,试纸变蓝。